
【题目】联合国大会宣布2019年是“国际化学元素周期表年”(I YPT 2019)·下列运用元素周期律分析的推断中,错误的是
A.铍(Be)的氧化物的水化物具有两性
B.砹(At)为有色固体,AgAt感光性很强,不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.NF3和BF3的杂化方式不同,前者是sp2后者是sp3
C.HCHO、CH3—、SO3的分子空间构型相同
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
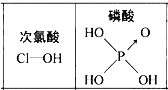
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是___酸(填强或弱)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式___。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
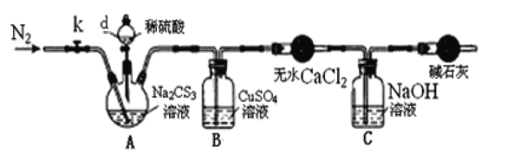
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是___。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为___。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用图1装置来制备1,2-二溴乙烷,利用图2装置来进一步精制。1,2-二溴乙烷是无色液体,密度为2.18g·cm-3,沸点为131.4℃,熔点为9.79℃,微溶于水,易溶于乙醇、乙醚、丙酮等有机溶剂。实验前将无水乙醇和浓硫酸按体积比1:3混合制得乙烯制备液。
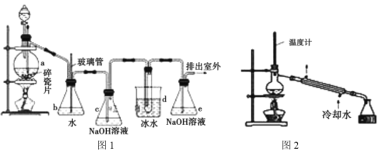
I.制备粗品
实验步骤:连接好装置,检查装置的气密性,分液漏斗中装乙烯制备液,d中装适量的液溴(表面覆盖少量水),其他药品按图1加入,打开分液漏斗旋塞滴入适量的液体后,关闭旋塞,点燃酒精灯加热使温度迅速升高到170℃直至反应完全,停止加热。回答下列问题:
(1)仪器a的名称为 _______,b装置的作用为 ___________ 。
(2)d装置中发生反应的化学方程式为 ___________ 。
(3)如果缺少C装置会导致1,2-二溴乙烷的产率降低,原因是___________(用离子方程式表示)。
(4)判断d中液溴反应完全的标准是 _____________。
II.制备精品
(5)d中制得的1,2-二溴乙烷中含有水,可先用__________方法进行分离,再将1,2 二溴乙烷用如图2 装置进行蒸馏,蒸馏时加入无水 Na2SO4的目的是_________,收集产品时,温度应控制在______左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽油的主要成分为辛烷,25℃、101KPa时,5.7g辛烷完全燃烧时,放出热量275.9kJ,则辛烷燃烧热的热化学方程式为( )
A.C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l) △H=-5518 kJ/mol
B.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-5518 kJ/mol
C.C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l) △H=+5518 kJ/mol
D.C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g) △H=-5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应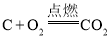 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中含有高浓度的![]() 、
、![]() ,在排放前必须进行脱硫、脱硝处理。回答下列问题:
,在排放前必须进行脱硫、脱硝处理。回答下列问题:
(1)利用![]() 可以将氮的氧化物还原为
可以将氮的氧化物还原为![]() 。
。
已知:![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]() 。
。
(2)在体积为1L的恒容密闭容器里,充入![]() 和
和![]() ,发生反应为:
,发生反应为:![]()
![]() ,得
,得![]() 随温度变化如图所示:
随温度变化如图所示:

①a点时,反应是否已达平衡状态________(填“是”或“否”)。
②该反应正反应的![]() ________(填“
________(填“![]() ”或“
”或“![]() ”)0。
”)0。
③当反应体系中![]() ,________(填“能”或“不能”)说明反应达平衡状态。
,________(填“能”或“不能”)说明反应达平衡状态。
④![]() ℃时该反应的平衡常数为________。
℃时该反应的平衡常数为________。
(3)工业上可以用![]() 溶液吸收
溶液吸收![]() ,并用电解法处理吸收后所得
,并用电解法处理吸收后所得![]() 溶液以实现吸收液的回收再利用(装置如图所示)。电源a端为________极,阳极的电极反应式为________。
溶液以实现吸收液的回收再利用(装置如图所示)。电源a端为________极,阳极的电极反应式为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com