
下列各组离子在指定条件下,一定能大量共存的是( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO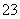 、NO
、NO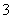
B.c(H+)=1×10-1 mol·L-1的溶液中:Cu2+、Al3+、SO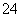 、NO
、NO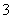
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH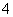 、S2-、Br-
、S2-、Br-
D.水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、Cl-、SO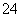
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
经测定由C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数是------------------------------------------------------------------------------------------------------( )
A.78% B.22% C.14% D.13%
查看答案和解析>>
科目:高中化学 来源: 题型:
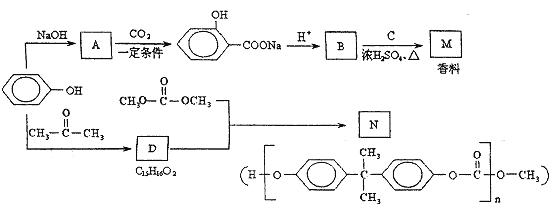
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去,转化关系图在下一页)
(1)由苯酚生成A的化学方程式是 。
(2)已知C的化学式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是 。
(3)B与C反应的化学方程式是 。
(4)生成N的反应类型是 ,D的结构简式是 。
(5)以苯酚为基础原料也可以合成防腐剂F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,F完全燃烧只生成CO2和H2O,则F的分子式是 。
已知: ①芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③F分子结构中不存在“—O—O—”的连接方式。 F的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则在相同温度下,下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4
B.AgCl> Ag2CrO4>AgI
Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI> AgCl
AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
铜锌原电池(如图)工作时,下列叙述正确的是( )
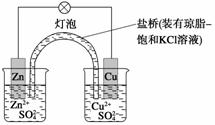
A.正极反应为:Zn-2e-===Zn2+
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
电解原理在化学工业中有着广泛的应用。现将设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
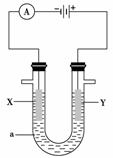
(1)若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是
________________________________________________________________________
________________________________________________________________________。
(2)若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为______________________________________________。
(3)若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.常温下,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1) 混合溶液的pH=8的原因(用离子方程式表示):
__________________________________________。
(2) 混合溶液中由水电离出的c(H+)_____0.1mol/LNaOH溶液中由水电离出的c(H+)。(选填“大于”、“小于”或“等于”)
(3) 求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=_________mol/L。
(4) 已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH__________7(选填“大于”、“小于”或“等于”);
Ⅱ.相同条件下,有pH均为4的盐酸、硫酸、醋酸三溶液,其物质的量浓度依次为
c1、c2、c3,则c1、c2、c3由大到小顺序为 。
Ⅲ.已知海水中镁离子浓度为1.8×10-3mol/L,且Ksp[Mg(OH)2] =1.8×10-11,常温下要使海水中镁离子产生沉淀,溶液的pH最低应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com