
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | HNO3的摩尔质量是63g | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| D. | 1mol氧含6.02×1023个O2 |
分析 A.摩尔只是物质的量的单位,不是物理量;
B.摩尔质量的单位为g/mol;
C.含有6.02×1023个粒子的任何粒子的集体约为1mol;
D.必须指出是氧气还是氧原子.
解答 解:A.物质的量为基本物理量,摩尔是物质的量的单位,故A错误;
B.HNO3的摩尔质量是63g/mol,故B错误;
C.物质的量表示含有一定数目微观粒子的集体,摩尔是物质的量的单位,科学上把含有的粒子数约为6.02×1023的任何粒子集体计量为1mol,故C正确;
D.1mol氧,没有说明是氧气还是氧原子,无法计算含有氧气分子的数目,故D错误;
故选C.
点评 本题考查了物质的量的计算与判断,题目难度不大,明确物质的量意义为解答关键,注意掌握摩尔质量与质量、物质的量与摩尔之间的关系及区别,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O+互为同分异构体 | |
| B. | H2O+有较强的氧化性 | |
| C. | 水分子形成的“网”是一种新化合物 | |
| D. | H2O(s)→H2O(l)→H2O(g)的变化过程中会破坏H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
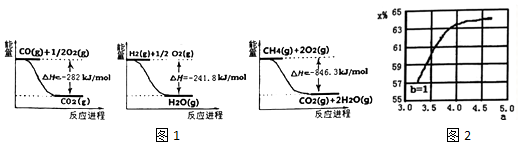
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 |
| B | 0.05molNaHSO4 | c(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl | 溶液中性,水的电离程度减小 |
| D | 50mLH2O | 由水电离出的c(H+)•c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的气态氢化物的水溶液具有强酸性 | |
| B. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| C. | R是金属元素 | |
| D. | R的气态氢化物不能在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气所含的原子数目为NA | |
| B. | 4 g金属钙变成离子时失去的电子数目为0.1NA | |
| C. | 22.4 L CH4的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4 L CH4和氧气的混合物所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如右图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如右图实验装置.依据实验设计,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com