
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
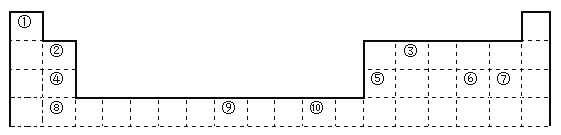
请回答下列问题:
(1)表中属于d区的元素是___________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_________。
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有______个,π键有______个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_______;该元素与元素①形成的分子X的空间构形为___________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
【答案】 ⑨ 苯 Cl> S> Mg> Al 2 2 1 三角锥形 Be(OH)2+2NaOH=Na2BeO2+2H2O
【解析】(1)区的名称来自于按照构造原理最后填入电子的轨道名称,属于表中属于d区的元素是⑨;(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子是苯;(3)④ ⑤ ⑥ ⑦四种元素分别是Mg、Al、S、Cl。金属性越强第一电离能越大。但由于镁元素的3s轨道电子处于全充满状态,所以第一电离能对于Al元素的,则第一电离能由大到小的顺序是Cl> S> Mg> Al;(4)按原子轨道的重叠方式,③与⑥形成的化合物是二硫化碳,分子中含有2个双键。而双键是由1个σ键和1个π键构成的,所以分子中σ键有2个,π键有2个;(5)某元素的特征电子排布式为nsnnpn+1,则该元素是第ⅤA族元素。所以该元素原子的核外最外层电子的孤对电子数为1;该元素与元素①形成的分子X是氨气,其空间构形为三角锥形结构,属于极性分子;(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。由于⑤是铝元素,能氢氧化铝能和氢氧化钠溶液反应生成偏铝酸钠和水,则元素②即Be的氢氧化物与NaOH溶液反应的化学方程式Be(OH)2+2NaOH=Na2BeO2+2H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。
(1)写出甲苯与干燥氯气在光照条件下反应合成氯化苄的化学方程式________________。
(2)用下列方法分析氯化苄粗产品的纯度:
步骤I:称取2.555 g样品于烧瓶中,加入100.00 mL 4mol/L氢氧化钠溶液共热,冷却至室温。加入100.00 mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL的容量瓶中,加水定容。
步骤II:从容量瓶中各取50.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
步骤m:用硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
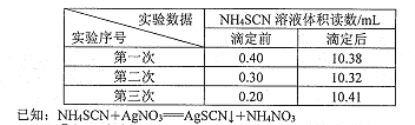
①加入硝酸的目的是____________。
②在步骤III操作中,判断达到滴定终点的现象是____。
③该样品中氯化苄的质量分数(写出计算过程)____。
④上述测定结果通常高于氯化苄中氯元素的理论含量,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。下列说法不正确的是( )
A. C、D、G三种元素形成的盐,水溶液可能呈碱性
B. A与B能形成离子化合物A5B,且既含有离子键又含有共价键
C. B、C、G的简单氢化物中C的氢化物稳定性最强
D. D、E、F、G形成的简单离子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.NaHCO3、CH4均含有离子键和共价键
B.晶体氦He中既无化学键又无分子间作用力
C.只含有共价键的物质是共价化合物
D.原子最外层电子数为5的元素一定是ⅤA族的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的结构表示不正确的是
A.CH4的球棍模型示意图为:![]()
B.乙烯的实验式为:CH2
C.乙醇的结构简式:C2H5OH
D.2-乙基-1,3-丁二烯分子的键线式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
Ⅰ.课本实验
(1)苯甲酸的重结晶实验操作步骤是_________、__________、__________、分离晶体,粗苯甲酸溶解后还要加点水的目的是________________。
(2)为了验证溴乙烷中含有溴元素,有以下操作:①加硝酸银溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性,合理的顺序是(______)
A、②①③⑤ B、②④⑤③ C、②③⑤① D、②①⑤③
(3)在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了实验方案来检验生成的气体是否为乙烯,如图所示。

①Ⅰ中水的作用____________。
②Ⅱ中还可用________________,若用此物质,此时______(填“有”或“无”)必要将气体先通入水中。
Ⅱ.拓展实验
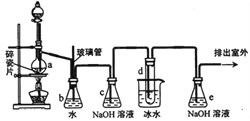
1,2一二溴乙烷可作抗爆剂的添加剂。下图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴。
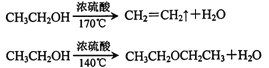
已知:
相关数据列表如下:
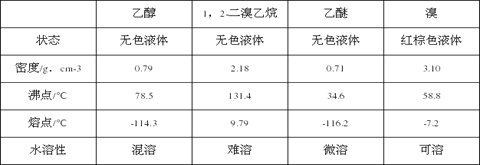
(1)实验中应迅速将温度升高到170℃左右的原因是__________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象__________________;如果实验中导管d堵塞,你认为可能的原因是__________________;安全瓶b还可以起到的作用是___________________________;
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________;
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因___________________________;
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是__________________(填入正确选项前的字母)。
A. 重结晶 B.过滤 C.萃取 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试求解。
(1)已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的物质的量浓度是________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的溶质的质量分数为________。
Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为____mol·L-1。
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,得到密度为1.19g/mL的盐酸,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为______,该盐酸的浓度为_____(结果均保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com