
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
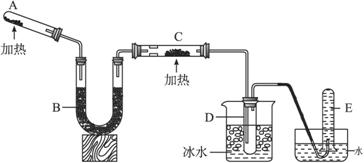
回答下列问题:
(1)A中加入的物质是_______________________,
发生反应的化学方程式是_______________________;
(2)B中加入的物质是____________,其作用是_______________________;
(3)实验时在C中观察到的现象是_______________________,发生反应的化学方程式是_______________________;
(4)实验时在D中观察到的现象是_________________,D中收集到的物质是____________,检验该物质的方法和现象是_______________________。
【答案】
(1)固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2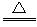 CaCl2+2NH3↑+2H2O(其他合理也可)
CaCl2+2NH3↑+2H2O(其他合理也可)
(2)碱石灰(或CaO) 除去NH3气流中的水汽
(3)黑色粉末部分逐渐变为红色 2NH3+3CuO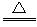 N2+3H2O+3Cu
N2+3H2O+3Cu
(4)出现无色液体 氨水 用红色石蕊试纸检验、试纸变蓝 用无水硫酸铜检验、无水硫酸铜变蓝
【解析】此题是氨气的实验室制取、除杂、反应、检验、尾气处理的一系列实验的综合,考查的内容比较基础。A为反应制NH3,则A中装有NH4Cl和Ca(OH)2。NH3与灼热氧化铜反应前要进行干燥,则B应为干燥装置,用碱石灰对其干燥。而NH3与CuO反应过程中不能完全参与反应,所以可用D装置来收集未参与反应的NH3。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
有机物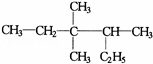 的正确命名为()
的正确命名为()
A. 2﹣乙基﹣3,3﹣二甲基﹣4﹣乙基戊烷
B. 3,3﹣二甲基﹣4﹣乙基戊烷
C. 3,3,4﹣三甲基己烷
D. 2,3,3﹣三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.1.5 mol/L C.0.18 mol/L D.0.24mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有石碱水的毛巾捂住口鼻撤离
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,PhCH2N3可用于合成化合物Ⅴ(见下图,仅列出部分反应条件,Ph-代表苯基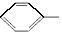 )。
)。
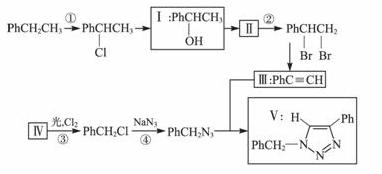
(1)下列说法不正确的是_____________(填字母)。
A.反应①④属于取代反应
B.化合物Ⅰ可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ 能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为_______________(不要求写出反应条件)。
(3)反应③的化学方程式为__________________(要求写出反应条件)。
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物Ⅴ,不同条件下环加成反应还可生成化合物Ⅴ的同分异构体。该同分异构体的分子式为______________,结构式为___________。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NCCCl3反应成功合成了该物质。下列说法正确的是_____________________(填字母)。
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4 C+6N2↑
C+6N2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(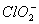 )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中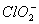 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、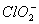 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为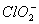 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,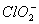 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时,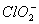 与I-反应的离子方程式__________________________。
与I-反应的离子方程式__________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加 入到锥形瓶中。
入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中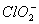 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中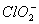 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将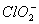 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+ I2+Z+H2O常作为Y的鉴定反应。
I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_________________________________________________________________
___________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
___________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是__________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)_____________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为 1g,MmRn质量为
1g,MmRn质量为 2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含
2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含 和a的代数式表示)。
和a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
②下图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平 衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.
衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com