1.随着大气污染的日趋严重,“低碳减排”备受关注,研究NO
2、SO
2、CO等大气污染气体的处理具有重要意义.
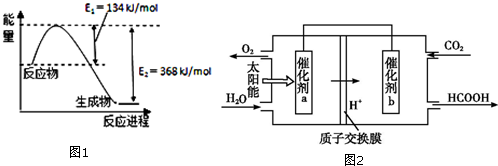
(1)图1是在101kP
a,298k条件下1mol NO
2和1mol CO反应生成1mol CO
2和1mol NO过程中能量变化示意图.已知:
N
2(g)+O
2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O
2(g)═2NO
2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N
2(g)+2CO
2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO
2.
①下列说法正确的是abc.(填序号)
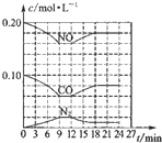
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO
2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH
4催化还原NO
x可以消除氮氧化物的污染.
例如:CH
4+2NO
2=N
2+CO
2+2H
2O,当生成14gN
2时,转移电子数目是2.408×10
24②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO
2(g)和H
2O(g)为原料制备HCOOH和O
2的原理示意图.催化剂b表面发生的电极反应式为CO
2+2H
++2e
-=HCOOH.
③25℃时,部分物质的电离平衡常数如图所示:
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7
Ki2=5.6×10-11 | 3.0×10-10 |
请回答下列问题:
同浓度的HCOO
-、HCO
3-、CO
32-、ClO
-结合H
+的能力有强到弱的顺序是CO
32->ClO
->HCO
3->HCOO
-,物质的量浓度均为0.1mol•L
-1的下列四种物质的溶液:a、Na
2CO
3;b、NaClO;c、HCOONa;d、NaHCO
3,pH由小到大的顺序是c<d<b<a(填编号)