
| A、1molFeCl3完全水解生成Fe(OH)3胶体,其中Fe(OH)3胶粒的个数为NA个 |
| B、25℃时,1L纯水中的H+数目约为10-14NA个 |
| C、1mol/L的盐酸溶液中Cl-的个数为NA个 |
| D、1L 1mol/L的Na2CO3溶液中所含阴离子的总数目大于NA个 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷完全燃烧的热化学方程式为C3H8+5O2═3CO2+4H2O△H=-2 036 kJ/mol |
| B、C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H<-2 036 kJ/mol |
| C、丙烷完全燃烧的热化学方程式为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=2 036 kJ/mol |
D、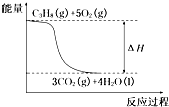 丙烷燃烧的能量变化可用如图所示表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某元素的原子半径是0.160 nm |
| B、某常见气体的密度为1.8 g/cm3 |
| C、某澄清石灰水的浓度是4.0 mol/L |
| D、某溶液中溶质的质量分数120% |
查看答案和解析>>
科目:高中化学 来源: 题型:
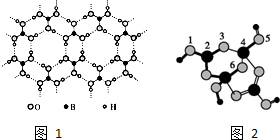 硼酸晶体具有层状结构,每一层的结构结构如图1所示.
硼酸晶体具有层状结构,每一层的结构结构如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com