
| A.2mol/L | B.4 mol/L | C.6 mol/L | D.8mol/L |
科目:高中化学 来源:不详 题型:实验题


| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有8.4g铜生成 |
| B.有8g氧化铜参加反应 |
| C.有1.6g水生成 |
| D.有10g氧化铜被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
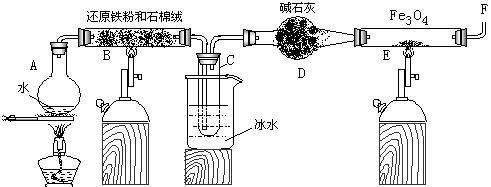
 Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸和浓硝酸都具有氧化性 |
| B.铜和浓硫酸的反应属于置换反应 |
| C.在铜和浓硝酸的反应中,硝酸只发挥了氧化性,没有体现酸性 |
| D.可用铝或铁制容器盛装稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ( )
( ) | A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 |
| B.用食醋除去水壶内壁上的水垢时所发生的反应是水解反应 |
| C.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
| D.将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入NH3,仍不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.60 g | B.2.76 g | C.4.36 g | D.5.54 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com