
【题目】在一个温度和体积不变的容器中,硫可以发生如下变化,其反应过程和能量关系如图1所示。(SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.45kJ·mol-1)
SO3(g) △H=-98.45kJ·mol-1)
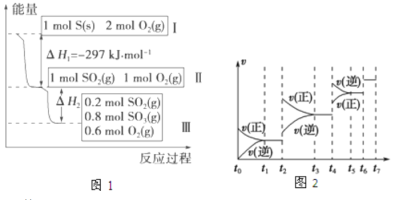
(1)硫燃烧的热化学方程式为 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有 。
A.降低温度 B.充入He C.再充入1mol SO2(g)和1mol O2(g) D.使用催化剂
(3)恒温恒容时,图1中II到III反应放出的热量比1mol SO2和2mol O2充分反应放出的热量 (填
“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。(如t1~t2、t3~t4、t5~t6、t6~t7等)
【答案】(1)S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
(2)AC(3)小(4)增大压强 t3~t4
【解析】
试题分析:(1)根据图1硫燃烧饿热化学反应方程式为S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1;
(2)A、降低温度,根据勒夏特列原理,平衡向正反应方向进行,比值增大,A正确;B、恒容状态下,充入非反应气体,各组分的浓度不变,比值不变,B错误;C、再充入1molSO2和1molO2,相当于在原来基础加压,平衡向正反应方向移动,比值增大,C正确;D、使用催化剂,平衡不移动,比值不变,D错误,答案选AC;
(3)通入1molSO2和2molO2,改成先通入1molSO2、1molO2,两者属于等效平衡,放出的热量相等,然后再通入1molO2,平衡向正反应方向移动,放出热量比通入1molSO2、1molO2放出热量多;
(4)t2时,正逆反应速率都增大,如果升高温度,虽然正逆反应速率都增大,但平衡向逆反应方向进行,不符合题意,增大压强,正逆反应速率都增大,平衡向体积减小的方向移动,即向正反应方向移动,符合题意,SO3含量最高,即平衡向正反应方向进行,t3~t4SO3含量最高。


科目:高中化学 来源: 题型:
【题目】下列小实验不能成功的是( )
A. 用活性炭将硬水软化 B. 用紫卷心菜自制酸碱指示剂
C. 用食醋制无壳鸡蛋 D. 用灼烧闻气味的方法区分棉纤维和羊毛纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
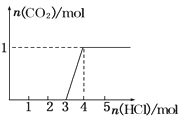
A.通入的CO2气体为22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏和煤的液化均是物理变化
B.天然纤维和合成纤维的主要成分都是纤维素
C.海水淡化的方法有蒸馏法、电渗析法等
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
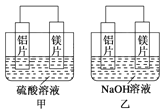
(1)写出甲中正极的电极反应式___________________。
(2)乙中总反应的离子方程式:________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出_____________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有______________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不涉及氧化还原反应的是( )
A.古代用铜矿石、锡矿石冶炼铸造青铜器
B.出土后的青铜器大多数已受到锈蚀
C.古代用明矾溶液清除青铜镜表面的锈斑
D.现代用双氧水去除青铜器上有害的CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3 | H2PO4- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 1 | 0.35 | 1 | 2 | 1 | 0.25 | 1 |
A.Ca2+B.SO42-C.Zn2+D.H2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时下列说法正确的是 ( )
A. 18O只存在于乙酸乙酯中
B. 18O存在于水、乙酸、乙醇以及乙酸乙酯中
C. 18O存在于乙酸乙酯、乙醇中
D. 若与丙酸反应生成酯的相对分子质量为102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用98%的浓H2SO4(ρ="1.84" g/cm3)配制成浓度为1.0mol/L的稀硫酸250 mL。
(1)现有主要仪器:A量筒 B烧杯 C玻璃棒 D胶头滴管 还缺少的仪器_______________;
(2)请将下列操作序号按正确顺序填在横线上:
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加水至刻度
D.洗涤烧杯、玻璃棒2-3次
E.稀释浓H2SO4
F.冷却后将溶液转入容量瓶
其操作正确顺序为__________________;
(3)下列操作中,容量瓶所不具备的功能有________(填序号);
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.贮存溶液
E.用来加热和溶解固体溶质
(4)简要回答下列问题
①所需浓H2SO4的体积为___________mL;
②将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌,若搅拌过程中有液体溅出,会使最终结果_________ (填“偏高”、“偏低”或“无影响”,下同);若将量筒洗涤转移到容量瓶会使最终结果_________ ;定容时水加多后用滴管吸出会使结果_________;
(5)该浓硫酸与等质量的水混合所得溶液的物质的量浓度________9.2 mol/L (填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com