
某同学设计如下实验方案,并记录了有关实验现象,如下表。请你帮助该同学整理完成实验报告。
(1)实验目的:______________________________________________________。
(2)实验用品:仪器__________________________________________________。
试剂_______________________________________________________________。
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞溶液 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞的冷水反应 4.镁带与2 mol·L-1盐酸反应 5.铝条与2 mol·L-1盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成闪亮的小球,四处游动,逐渐缩小,溶液变红色 B.产生大量的气体,气体可燃,溶液变浅红色 C.反应较剧烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色胶状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
(3)实验内容:
| 实验方案* | 实验现象* | 有关化学方程式 |
(4)实验结论:_______________________________________________________________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
(1)验证第3周期元素从左到右金属性和非金属性的递变规律
(2)仪器:试管、烧杯、酒精灯、滤纸、砂纸、镊子、小刀、胶头滴管、火柴
试剂:钠、镁条、铝片、新制氯水、新制饱和H2S溶液、2 mol·L-1盐酸、NaOH溶液、蒸馏水、酚酞溶液、AlCl3溶液
(3)1 B Mg+2H2O![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
2 F H2S+Cl2====2HCl+S↓
3 A 2Na+2H2O====2NaOH+H2↑
4 D Mg+2HCl====MgCl2+H2↑
5 C 2Al+6HCl====2AlCl3+3H2↑
6 E AlCl3+3NaOH====Al(OH)3↓+3NaCl
Al(OH)3+NaOH====NaAlO2+2H2O
(4)Na、Mg、Al、S、Cl元素,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强
(5)①同一周期元素从左到右随着原子序数的递增,原子半径逐渐减小,核对外层电子的吸引力逐渐增强,因而失电子的能力逐渐减弱,得电子的能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
②另两种未验证的元素为Si、P。可以设计以下实验确认其非金属性强弱:向Na2SiO3溶液中滴加H3PO4溶液,若产生白色胶状沉淀,则说明H3PO4比H2SiO3酸性强,从而证明磷元素的非金属性比硅强。(其他合理方法也可)
本实验选取了教材中演示实验的部分内容,并提供了一些补充实验的方案和实验现象,要求写出实验原理、所需仪器和试剂,并归纳出实验结论及进行相关的讨论和实验设计。解答这类题首先要根据题目要求和给出的条件,确定与教材相关的知识点及实验原理,构思相关实验情景,结合题意回答相关问题。


科目:高中化学 来源:安徽省模拟题 题型:实验题
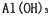

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com