

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
分析 用盐酸酸浸时SiO2不溶解,过滤分离,滤渣A为SiO2,滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤分离,滤液中再加入ZnS,Cu2+转化为CuS沉淀,过滤除去的滤渣B为CuS,滤液中主要为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等;
(1)由分析可知,烟道灰中的成分不溶于稀盐酸的应该是二氧化硅;
(2)滤渣B为CuS,加入ZnS是利用沉淀的转化将溶液里的Cu2+转化为CuS;
(3)除铁(部分Cu2+可能被除去)时加入ZnO控制pH使铁离子沉淀完全,而Zn2+不能沉淀;
(4)①三价铁离子具有强的氧化性能够氧化硫化氢生成单质硫;
②电解池的阴极是溶液中的H+发生还原反应生成氢气;
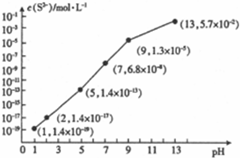
(5)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;根据MnS和FeS的Ksp计算;
解答 解:用盐酸酸浸时SiO2不溶解,过滤分离,滤渣A为SiO2,滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤分离,滤液中再加入ZnS,Cu2+转化为CuS沉淀,过滤除去的滤渣B为CuS,滤液中主要为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等;
(1)由分析可知,滤渣A为SiO2,故答案为:SiO2;
(2)利用相同条件下CuS的溶解度明显小于ZnS,加入ZnS可将溶液里Cu2+转化为沉淀CuS,离子反应式为:ZnS+Cu2+=CuS+Zn2+,故答案为:ZnS+Cu2+=CuS+Zn2+;
(3)除铁(部分Cu2+可能被除去)时加入ZnO控制pH使铁离子沉淀完全,而Zn2+不能沉淀,故控制反应液pH的范围为3.3~5.4,
故答案为:3.3~5.4;
(4)①FeCl3与H2S反应生成硫单质、二价铁离子和水,离子方程式为 2Fe3++H2S=2Fe2++S↓+2H+;
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
②阴极生成氢气,电极反应式:2H+-2e-=H2↑,故答案为:2H+-2e-=H2↑;
(5)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(FeS)时开始沉淀,所以c(S2-)=$\frac{{K}_{sp}(FeS)}{c(F{e}^{2+})}$=$\frac{1.4×1{0}^{-19}}{0.01}$mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时亚铁离子开始沉淀;
溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(FeS)}$=$\frac{2.8×1{0}^{-13}}{1.4×1{0}^{-19}}$mol/L=2×106;
故答案为:2;2×106.
点评 本题考查物质制备工艺流程,关键是对工艺流程的理解,涉及陌生方程式书写、物质的分离提纯、对条件的控制与分析、原电池原理及计算等,是对学生综合能力的考查,是高考常考题目,熟练掌握元素化合物性质.


科目:高中化学 来源: 题型:推断题
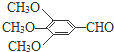 )和抗癫痫药物H(
)和抗癫痫药物H(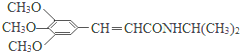 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):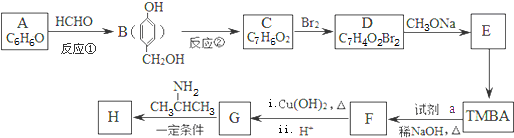
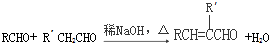 (R、R′表示烃基或氢)
(R、R′表示烃基或氢) ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→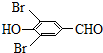 +2HBr.
+2HBr. .
.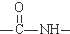 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式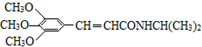 +NaOH→
+NaOH→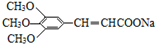 +H2NCH(CH3)2.
+H2NCH(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| C. | 参加反应的金属的总质量3.6 g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;| 梨汁 | 苹果汁 | 橙汁 | 0.04%的Vc溶液 | |
| 滴加的滴数 | 40 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
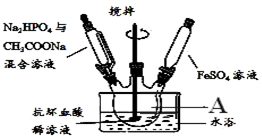
 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
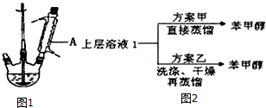 实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下:
实验室以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸.反应式如下: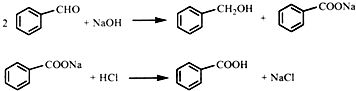
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 熔点 (℃) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 179.6 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 针状结晶 | 1.27 | 122.1 | 249 | 0.21g | 46.6g | 66g |
| 苯甲醇 | 108 | 无色液体 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | 无色液体 | 0.71 | -116.3 | 34.6 | 不溶 | 易溶 | 一 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 9种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.015 mol/(L•s) | ||
| C. | v(C)=0.40 mol/(L•min) | D. | v(D)=0.45 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 g CH4中含有的C-H键数目为0.4 NA | |
| B. | 0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA | |
| C. | 加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA | |
| D. | 标准状况下,2.24 L H37Cl含有的中子数为2.0 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com