
����Ŀ��ij��ѧʵ��С����̽���Ľ�Fe(OH)2����ȡ������
����1��
��ʵ��ҩƷ��FeS���塢ϡ������Һ��NaHCO3��Һ��
��ʵ��װ����ͼ1��
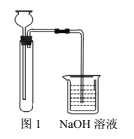
����2��
��ȡһֻ�Թܣ������м���һ��NaOH���壬�ټ���Լ2mL���Ƶ�FeSO4��Һ��
�ڽ��Թ����ھƾ��ƻ����ϣ�������NaOH�����IJ�λС�ļ���(����ʹҺ����ҷ���)��ʹ�������������������࣬�۲��²�������ɫ��
����3��
�������Թ��е���2~3 mLҺ��ʯ����
���ý�ͷ�ι�С�����Թܵײ�ע��4~5 mL���Ƶ�FeSO4��Һ��
�������Թ���Ͷ��1���̶���С�Ľ����ƣ��۲췴Ӧ����
�ش��������⣺
(1)������1���У�������Թ��е�Һ����______��NaOH��Һ��������_______��
(2)������2���У�������NaOH�����IJ�λС�ļ��ȵ�Ŀ����________��
(3)������2���ij����У��ϲ��������ɫ��________���²��������ɫ��________�������������ԭ����________��
(4)������3���з�Ӧ�Ļ�ѧ��Ӧ����ʽΪ________��
(5)������3����ʵ������м���Եij��ְ�ɫ��������ԭ����_________��
���𰸡�NaHCO3��Һ ����H2S���壬��ֹ��Ⱦ���� ���ȿ��ƻ�NaOH�������Fe(OH)2�����İ�����ʹ��Ӧ�������� ����ɫ ��ɫ �ϲ��������ˮ���ܽ��O2ת��Ϊ����ɫ�Ľ�״��ﵽ�����²��ɫFe(OH)2������Ŀ�� 2Na+2H2O+FeSO4=Fe(OH)2��+Na2SO4+H2�� ��������Һ��ʯ���������³���һ����FeSO4��Һ�Ӵ����ͷų��������ݣ����Ѹ���ϸ���������Һ����ʯ���㣬������������������Һ����ԽӴ�
��������
(1)����FeS�����ᷴӦ����Fe2+��Ȼ������Һ�м���NaHCO3��Һ���������ֽⷴӦ����Fe(OH)2������CO2���壻NaOH�Ǽ�ܹ����������巢����Ӧ��
(2)(3)FeSO4��NaOH�������ֽⷴӦ����Fe(OH)2���������嵼���Բ�����¶ȿ��ƻ������㣻Fe(OH)2���ױ�O2��������Fe(OH)3���������ʳɷַ������ж�ʵ������
(4)(5)Һ��ʯ�����Ը���������Na����Һ�е�ˮ��Ӧ����NaOH��NaOH��FeSO4��Ӧ����Fe(OH)2��ɫ������
(1)��FeS�����Թ��У�ͨ����Һ©�������м������ϡ���ᷢ����Ӧ��FeS+H2SO4=FeSO4+H2S��������Һ�й��弸����Ӧ��ȫʱ�������м���NaHCO3��Һ����������ᷴӦ��2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2����������NaHCO3��Һ����Һ��Fe2+��Ӧ����Fe(OH)2������CO2���壬CO2������Է�ֹ�����е�O2���뵽��Ӧװ�ã����Խϳ�ʱ��۲쵽Fe(OH)2��ɫ������NaOH��Һ������������H2S���壬��ֹ��Ⱦ������
(2) ������2���У�������NaOH�����IJ�λС�ļ��ȵ�Ŀ���ǿ��ƻ�NaOH�������Fe(OH)2�����İ�����ʹ��Ӧ�������У�
(3)����ʱNaOH��������������Һ�е�FeSO4��Һ������Ӧ��FeSO4+2NaOH=Na2SO4+Fe(OH)2���������ϲ�Һ���к����ܽ������е�O2���ֻᷢ����Ӧ��4Fe(OH)2+O2+2H2O=4Fe(OH)3����˻ῴ���ϲ�����ɰ�ɫ��Ϊ����ɫ���²����Ϊ��ɫ�������������ԭ�����ϲ��������ˮ���ܽ��O2ת��Ϊ����ɫ�Ľ�״��ﵽ�����²��ɫFe(OH)2������Ŀ�ģ�
(4) ������3����Na����Һ�е�H2O��Ӧ����NaOH��H2��NaOH����Һ�е�����FeSO4�������ֽⷴӦ����Fe(OH)2��ɫ������Na2SO4����Ӧ���ܻ�ѧ��Ӧ����ʽΪ2Na+2H2O+FeSO4=Fe(OH)2��+Na2SO4+H2����
(5) ������3����ʵ������м���Եij��ְ�ɫ��������ԭ���ǽ�������Һ��ʯ���������³���һ����FeSO4��Һ�Ӵ����ͷų��������ݣ����Ѹ���ϸ���������Һ����ʯ���㣬������������������Һ����ԽӴ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ�ֽ���ѧ��ת��Ϊ���ܵĸ�Ч�������Ѻõķ���װ�ã��õ�صĹ�����ͼ��ʾ�����з����жϴ������
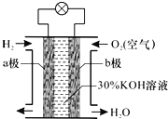
A��a��������b������
B����������������Ӧ
C�������ĵ缫��ӦΪO2+2H2O+2e���T4OH��
D�������ĵ缫��ӦΪH2+2OH����2e���T2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(��Ҫ��Fe2O3��FeO������ΪAl2O3��SiO2��)����������������(FeOOH)���Ʊ��������£�

(1)�����ܡ�ʱ��Fe2O3�����ᷴӦ�����ӷ���ʽΪ___________________________��
(2)���������Ҫ�ɷ���FeS2��S��________(�ѧʽ)��Fe3����FeS2��ԭ�����ӷ���ʽΪ_______________��
(3)���������У�����FeOOH�����ӷ���ʽΪ________________��
(4)��Һ����������Al2(SO4)3��________(�ѧʽ)����ϴ�ӡ�ʱ���������Ʊ�����ϴ�Ӹɾ��IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
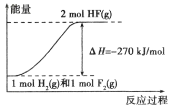
����Ŀ����֪��![]()
![]() ������˵����ȷ��( )
������˵����ȷ��( )
A.����ͬ�����£�1mol![]() ��1mol
��1mol![]() �������ܺʹ���2mol
�������ܺʹ���2mol![]() ������
������
B.1mol![]() ��1mol
��1mol ![]() ��Ӧ����2 molҺ̬HF�ų�������С��270kJ
��Ӧ����2 molҺ̬HF�ų�������С��270kJ
C.�÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ
D.�÷�Ӧ���̵������仯������ͼ����ʾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2S��Ʒ�������ʣ��䴿���������ⶨ�������¡��ش��������⣺
(1)��Ʒ��ˮ�������ˡ�__________________��ϴ�ӡ�����Ȳ������Գ�ȥ���������ʣ��õ��ϴ���Na2S���塣
(2)�����в�����ͼ��ʾװ�òⶨNa2S��Ʒ��Һ��Na2CO3�İٷֺ���(ʵ��ǰ�����չ�1�����չ�2���αȹ��о�װ�������ͬ���Ҵ�����ͪ�����Һ������Һ����CO2����ɫ�����ı�) ��

������һ���궨KOH����Һ
ȷ��ȡw g�ڱ����������(KC8H5O4��Ħ������ΪM g/mol)������ƿ�У�������������ˮ��2��ָʾ�����ô��궨��KOH��Һ�ζ����յ㣬����v mL KOH��Һ��
�ٱ궨������Ӧ��ѡ�õ�ָʾ��������______��������__________��
(��֪�ڱ�������ĵ���ƽ�ⳣ��ΪKa1=1.1��10-3��Ka2=4.0��10-6)
��KOH��Һ��ȷŨ��Ϊ_____mol/L(�ú�M��v��w�Ĵ���ʽ��ʾ)
�����������������ƿ���Ⱥ����100mL ��Ʒ��Һ��15 ml����������Һ(����)�����Ӻ�װ�ã����Ȳ�����װ�ã�
����������������Ӧ��ɺӵ�Һ©����������������ϡ������Һ����ַ�Ӧ��
�������ģ���װ��6�е�KOH����Һ�ζ����չ�1�е���Һ����αȹ�����Һ��ͬ����ɫ��3 min�ڲ���ɫΪ�յ㡣
�۹��������������______����ʯ��������__________��
����������ٶȹ��죬���ܵ��²ⶨ���_________(����ƫ��������ƫ����������Ӱ����)��
�����������г���_______________________(������)��˵��ʵ��ʧ�ܣ��������²ⶨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�������ݻ���ͬ�������٢ڢ��н������·�Ӧ��3A(g)��B(g) ![]() 2C(g) ��H<0������ʼ�¶���ͬ���ֱ�������������ͨ��3 mol A��1 mol B����ﵽƽ��ʱ��������C���ʵ���������ɴ�С��˳��Ϊ�� ��
2C(g) ��H<0������ʼ�¶���ͬ���ֱ�������������ͨ��3 mol A��1 mol B����ﵽƽ��ʱ��������C���ʵ���������ɴ�С��˳��Ϊ�� ��
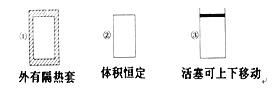
A. �ۢڢ�B. �ۢ٢�C. �٢ڢ�D. �ڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϩ���Ľṹ��ʽΪ��![]() ���мס��ҡ���������λͬѧ�ֱ�������Ϊ��2-��-4-�һ�-4-��ϩ��2-�춡��-1-��ϩ��2,4-����-3-��ϩ��4-��-2-�һ�-1-��ϩ�������4λͬѧ�������ж���ȷ����
���мס��ҡ���������λͬѧ�ֱ�������Ϊ��2-��-4-�һ�-4-��ϩ��2-�춡��-1-��ϩ��2,4-����-3-��ϩ��4-��-2-�һ�-1-��ϩ�������4λͬѧ�������ж���ȷ����
A. ����������ѡ���Ǵ����
B. �ҵ�����������̼ԭ�ӵı���Ǵ����
C. ������������ѡ������ȷ��
D. ������������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������õ�������ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ���� | ���� |
A | �ڵ��з�̪��Na2CO3��Һ�У�����BaCl2��Һ | ��Һ��ɫ | BaCl2��Һ������ |
B | ��25mL��ˮ�еμ�5��6��FeCl3������Һ��������� | ���ɺ��ɫ���� | �Ƶ�Fe(OH)3���� |
C | ��H2S��Һ�еμ�CuSO4��Һ | ������ɫ���� | H2S���Ա�H2SO4ǿ |
D | ����֧ʢ��KI3��Һ���Թ��У��ֱ�μӵ�����Һ��AgNO3��Һ | ǰ����Һ�����������л�ɫ���� | KI3��Һ�д���I2��I- |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л������
�ף�![]() �ң�
�ң�![]() ����
����![]() ����
����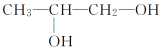
�Իش�
(1)�ס��ҡ��������еĹ����ŵ�������________�����������л�Ϊͬ���칹�����________(���ţ���ͬ)��
(2)1 mol�ס��ҡ����ֱ�������Na��Ӧ������H2������_______________��
(3)��������ڴ��������·���ȡ����Ӧ���ɵ�����__________�֡�
(4)��д�������Ҵ�����������Ӧ�Ļ�ѧ����ʽ��_____________________��
��д����������������ͭ����Һ��Ӧ�Ļ�ѧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com