
【题目】已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为( )
A.0B.+2C.+3D.+4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①NaCO310H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3固体。
(1)上述物质属于电解质的有(填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式。
(3)制取⑦的化学方程式;将⑥的溶液滴加到⑤的溶液中至恰好完全沉淀时的离子方程式。
(4)17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为。
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O当有0.6mol电子转移时,生成的气体标准状况下的体积为L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质. 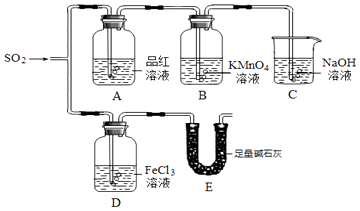
请回答:
(1)仪器E的名称是 . 若没有装置C,将气体直接排放到空气中,会带来的主要环境问题是 .
(2)观察到B中溶液颜色变浅,说明了SO2具有的性质是;
(3)写出仪器D中的实验现象 , 发生氧化还原反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取纯净、干燥的Cl2 , 并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A中所放试剂为 , B中所放试剂为 , 二者反应的化学方程式为 , 该反应中的氧化剂是;
(2)C中试剂是;D中试剂的作用是;
(3)E中现象是; F中现象是 , 其反应的化学方程式为;F管中脱脂棉的作用是
(4)H中试剂为;
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是(用①或②填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Zn+Cu2+= Zn2++ Cu设计成原电池。则该电池的负极、正极和电解质溶液选择合理的是
A. Zn、Cu、ZnSO4B. Cu、Zn、 ZnCl2
C. Cu、Zn、CuCl2D. Zn、Cu、CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3﹣可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4﹣ . 通电电解,然后通入H2S加以处理,下列说法不正确的是( ) 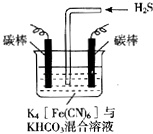
A.电解时阳极反应式为[Fe(CN)6]4﹣﹣e﹣=[Fe(CN)6]3﹣
B.电解过程中阴极区溶液的pH变大
C.整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
D.通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3﹣+2CO32﹣+H2S=2[Fe(CN)6]4﹣+2HCO3﹣+S↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com