
 |  |  |  | |
| 添加试剂 | 10.0mlFeSO4溶液 | 10.0mlFeSO4溶液+2ml煤油 | 10.0mlFeSO4溶液+1.0铁粉 | 10.0mlFeSO4溶液+ 少量(或几滴)硫酸 |
| 3天内的现象 | 溶液颜色很快变成黄色,并出现棕黄色浑浊 | / | / | / |
分析 (1)根据绿矾溶液变质后产生Fe3+,利用Fe3+的检验方法;
(2)根据滴定实验的反应终点时发生的反应进行计算;
(3)【反应原理】根据得失电子相等配平方程式;
【操作与现象】根据硫酸能抑制 FeSO4溶液的水解;根据Fe2+在溶液中被氧气氧化生成Fe3+和氢氧化铁;
【分析与结论】根据保存FeSO4溶液需考虑隔绝空气,防氧化和水解
解答 解:(1)绿矾溶液变质后产生Fe3+,向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色,说明变质;
故答案为:向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色;
(2)消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL,舍去第二组数据,求出KMnO4溶液体积为20.00mL,
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.02000L
计算得到;n(Fe2+)=0.001mol;
滤液中Fe2+物质的量浓度$\frac{0.001mol}{0.02500L}$=0.04000 mol/L
故答案为:0.04000 mol/L;
(3)【反应原理】该反应中,氧气得电子生成氢氧根离子,铁元素由+2价→+3价,失去1个电子,氧气中氧元素的化合价由0价→-2价,得到2个电子,一个氧气分子得到4个电子,所以得失电子最小公倍数是4,然后再结合原子守恒进行配平,所以其反应方程式为:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+,
故答案为:12、3、6 H2O;4、8;
【操作与现象】硫酸能抑制 FeSO4溶液的水解,便于与实验1对比;
Fe2+在溶液中被氧气氧化生成Fe3+和氢氧化铁,所以10.0mL FeSO4溶液颜色很快变成黄色,并出现棕黄色浑浊;
故答案为:少量(3滴)硫酸;溶液颜色很快变成黄色,并出现棕黄色浑浊;
【分析与结论】保存FeSO4溶液需考虑隔绝空气,防氧化和水解,所以试管①作空白对照实验;为了有效保存FeSO4溶液,可用煤油隔绝空气,并加入少量的铁屑和稀硫酸;
故答案为:作空白对照实验;用煤油隔绝空气,并加入少量的铁屑和稀硫酸.
点评 本题考查了物质存在和含量的实验探究方法和实验设计判断,氧化还原反应、水解原理的分析应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
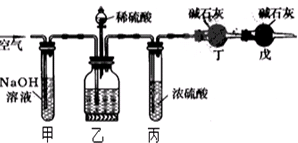
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
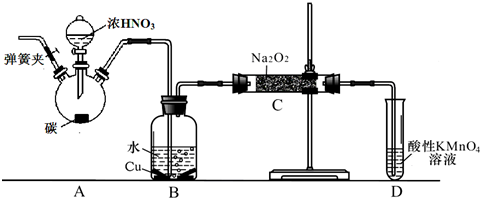
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
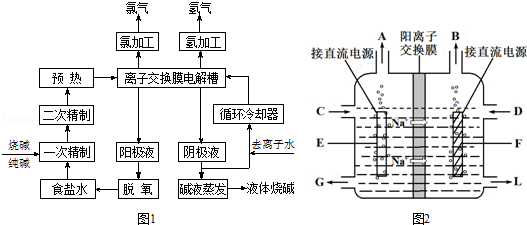
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com