
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)根据溶液呈电中性的原理可得:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-),将各个数值代入上述式子可得c(H+),再根据pH=-lgc(H+)计算;
(2)①已知:Ⅰ.2H2(g)+O2(g)=2H2O(g) K1,
Ⅱ.2C(s)+O2(g)=2CO(g) K2,
根据盖斯定律,(Ⅱ-Ⅰ)÷2可得:C(s)+H2O(g)=H2(g)+CO(g),故平衡常数为K2与K1的商再开方;
②SO2是酸性氧化物,能与碱反应,亚硫酸酸性比碳酸强,比盐酸弱,二氧化硫能与碳酸钠溶液反应,不能与氯化钙溶液反应,SO2与NaHSO3溶液不反应;
(3)①在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol,n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol,n(O2)=(0.2-4×10-4)mol,n(NO)=8×10-4mol,反应前后气体的体积不变,可以用物质的量代替浓度代入K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$计算平衡常数;
②由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应,若体系的△G=△H-T•△S<0,反应可以实现,否则不能实现;
③CO与NO反应生成氮气与二氧化碳,配平书写方程式.
解答 解:(1)根据溶液呈电中性的原理可得c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-),将各个数值代入上述式子可得c(H+)=1.0×10-4mol/L,所以pH=-lg1.0×10-4=4,
故答案为:4;
(2)①已知:Ⅰ.2H2(g)+O2(g)=2H2O(g) K1,
Ⅱ.2C(s)+O2(g)=2CO(g) K2,
根据盖斯定律,(Ⅱ-Ⅰ)÷2可得:C(s)+H2O(g)=H2(g)+CO(g),故该反应平衡常数K=$\sqrt{\frac{{K}_{2}}{{K}_{1}}}$,
故答案为:$\sqrt{\frac{{K}_{2}}{{K}_{1}}}$;
②A.可以发生反应:Ca(OH)2+SO2=CaSO3↓+H2O,故A正确;
B.可以发生反应:Na2CO3+SO2=Na2SO3+CO2,故B正确;
C.CaCl2不反应,不能作吸收剂,故C错误;
D.SO2与NaHSO3不反应,不能作吸收剂,故D错误,
故选:AB;
(3)①在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol,n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol,n(O2)=(0.2-4×10-4)mol,n(NO)=8×10-4mol.假设气缸的容积为VL.则该温度下的平衡常数K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$=$\frac{(8×1{0}^{-4})^{2}}{(0.8-4×1{0}^{-4})×(0.2-4×1{0}^{-4})}$=4×10-6,
②由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应,△H>0,△S<0,故体系的△G=△H-T•△S>0,所以该设想不能实现,
故答案为:△H>0,△S<0,故体系的△G=△H-T•△S>0,所以该设想不能实现;
③CO与NO反应生成氮气与二氧化碳,结合质量守恒定律可得反应方程式为:2CO+2NO=2CO2+N2,
故答案为:2CO+2NO=2CO2+N2.
点评 本题考查pH计算、盖斯定律应用、SO2的尾气处理、平衡常数计算及反应自发性判断,注意对平衡常数的理解,综合考查学生应用知识分析解决问题的能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
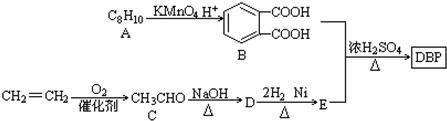
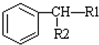 $\stackrel{KMnO_{2}H+}{→}$
$\stackrel{KMnO_{2}H+}{→}$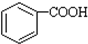
 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)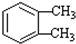 ,D→E的反应类型加成(或还原)反应.
,D→E的反应类型加成(或还原)反应.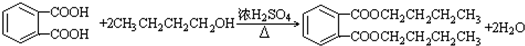 .
.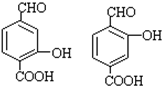 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
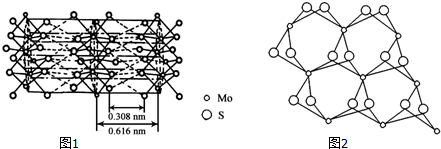
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=1mol/L,c(Cl-)=1mol/L,c(Ca2+)=2mol/L,c(ClO4-)=4mol/L | |
| B. | c(K+)=1mol/L,c(Mg2+)=1mol/L,c(Cu2+)=1mol/L,c(NO${\;}_{3}^{-}$)=4mol/L | |
| C. | c(OH-)=1mol/L,c(SO${\;}_{4}^{2-}$)=1mol/L,c(NH${\;}_{4}^{+}$)=6mol/L,c(HCO${\;}_{3}^{-}$)=1mol/L | |
| D. | c(Al3+)=1mol/L,c(SO${\;}_{4}^{2-}$)=1mol/L,c(OH-)=2mol/L,c(Na+)=2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热灼烧海带时要在蒸发皿中进行 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液一定含有Cl- | |
| D. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
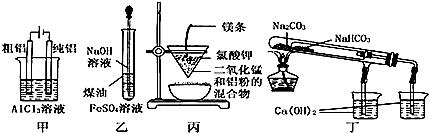
| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com