
����Ŀ����������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI=2KCl+I2���� �ش��������⣺
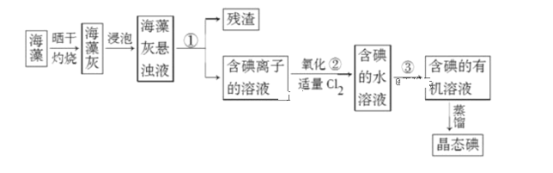
��1��ָ����ȡ��Ĺ������й�ʵ������ٺ͢۵����ƣ�________��________��
��2���� 3 mL ��ˮ�У����� 1 mL ���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________ (ע���Թ�����ɫ��Ϊ�Ϻ�ɫ��Һ)��

��3�����һ�������Ƶþ�̬��ʱ��������������ƿ�е��л���ʵ���ɫ���Ʋ���ԭ����__________
�������� 480mL0.5mol��L��1 �� NaOH ��Һ���Իش��������⡣
��4������������Һ��Ҫ�������У�ҩ�ס�������ƽ����Ͳ����������________��
��5��ijѧ��ʵ�����Ƶ� NaOH ��Һ��Ũ��Ϊ 0.51mol��L��1��ԭ�������_________��
A ʹ����ֽ���� NaOH ���� B ����ƿ��ԭ����������ˮ
C �ܽ����ձ�δ�����ϴ�� D �ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶�
E ��ˮʱ�����̶��ߣ��ý�ͷ�ι����� F ת����Һ֮ǰδ����ȴ
���𰸡����� ��ȡ��Һ D �ⵥ�������� 500 mL������ƿ���ձ�����ͷ�ι� D F
��������
��1������ɹ�����պ�õ�����ң����ݺ���ˣ���ҺΪ����I-����Һ������Һ��ͨ��һ�����������������ɽ�I-����ΪI2���õ�����I2��ˮ��Һ������ȡ��Һ���ɵõ���I2���л���Һ�������ɵõ�����⣻
��2�����ˮ�м������Ȼ�̼����������ȡ����Һ�ֲ㣬���л����ܶȴ���ˮ�㣻
��3������ʱ���������еĵ���ɫ����ΪI2����������
��4�������� 480mL0.5mol��L��1 �� NaOH ��Һ����������ƽ����һ��������NaOH���壬���ձ����ܽ⣬��ȴ�����º��ز���������Һת����500ml������ƿ�У�������ˮϴ���ձ��Ͳ�����2-3�Σ�ϴ��ҺҲע������ƿ��������ƿ�м�ˮ����̶���1-2cm�������ý�ͷ�ιܵμ�ˮ��ֱ����Һ����͵���̶������У��ݴ˷������
��5��A.NaOH�׳��⣬������ֽ������������������ճ����ֽ�ϣ�ʹ���ʵ������٣�
B. ����ƿ��ԭ����������ˮ������Һ��Ũ����Ӱ�죻
C. �ܽ����ձ�δ�����ϴ�ӣ����ʵ������٣�
D. �ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶ȣ�ʹ�����ˮ����ƫ�٣�
E. ��ˮʱ�����̶��ߣ��ý�ͷ�ι��������Ὣ����������������ʹ���ʵ������٣�
F. ת����Һ֮ǰδ����ȴ����ˮ���ݺ���Һ�����С��
��1���ɷ�����֪������Ϊ���ˣ�������Ϊ��ȡ��Һ��
��2�����ˮ�м������Ȼ�̼����������ȡ����Һ�ֲ㣬�γ�ˮ��͵�����Ȼ�̼��Һ�㣬�ҵ�����Ȼ�̼��Һ�ܶȴ���ˮ����ܶȣ���˵�����Ȼ�̼��Һ�����²㣬����Ҫ����Թ�ΪD��
��3����I2���������������ʱ���������е��л���ʵ���ɫ��
��4���ɷ�����֪�������� 480mL0.5mol��L��1 �� NaOH ��Һ����Ҫ������Ϊ��������ƽ���ձ�����������ҩ�ס���Ͳ��500ml����ƿ�ͽ�ͷ�ιܣ�
��5��A.NaOH�׳��⣬������ֽ������������������ճ����ֽ�ϣ�ʹ���ʵ������٣��������Ƶ���ҺŨ��ƫС��A�����
B. ����ƿ��ԭ����������ˮ������Һ��Ũ����Ӱ�죬B�����
C. �ܽ����ձ�δ�����ϴ�ӣ����ʵ������٣��������Ƶ���ҺŨ��ƫС��C�����
D. �ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶ȣ�ʹ�����ˮ����ƫ�٣�����������ҺŨ��ƫ��D����ȷ��
E. ��ˮʱ�����̶��ߣ��ý�ͷ�ι��������Ὣ����������������ʹ���ʵ������٣��������Ƶ���ҺŨ��ƫС��E�����
F. ת����Һ֮ǰδ����ȴ����ˮ���ݺ���Һ�����С������������ҺŨ��ƫ��F����ȷ��
��ѡDF��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����(����)
A.1 mol Na2O2�����к����ӵ�����Ϊ4NA
B.Na2O2��H2O��Ӧ����1.12 L O2(��״��)����Ӧ��ת�Ƶĵ�����Ϊ0.2NA
C.1 mol�������Ʒ�Ӧ��ת�Ƶĵ�����Ϊһ��Ϊ4NA
D.��1 mol�״�(CH4O)��ȫȼ�����ɵ�CO2��ˮ����ͨ��������Na2O2���壬��ַ�Ӧ���������32 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ʵ��һ��
��ͼ��ʾΪʵ������ȡ����ˮ��װ��ʾ��ͼ��

����ͼʾ�ش��������⣺
ͼ���������Դ����ǣ�
��________�� ��________��
(2)A������������________�� B������������________��
(3)ʵ��ʱ��A�г�������������ˮ�⣬����Ҫ����������________����������________��
(4)ʵ�����
�������岻��ȱ����Ԫ�أ�Ϊ�˷�ֹ��ȱ���������г�������һ�ּӵ��Σ������ھ���������һ������KIO3��ȥ��ij�о�С��Ϊ�˼��ij�ӵ������Ƿ��е⣬�������йص����ϣ���������ԭ����:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4����С����ȡ�����ļӵ��μ�����ˮ�ܽ⣬Ȼ�����ϡ�����KI��Һ��ת�Ƶ���Һ©���У��ټ���һ�����ı�������Һ©��ʹ��ǰӦ��________�����ϲ�Һ��Ϊ________�����л��㡢ˮ�㣩��
(5)��ȡ��ˮ�е�I2����ʱҪ�õ���ȡ�������й���������ȡ����˵����ȷ����______
A.����ⷴӦ
B.�������е��ܽ��Զ������ˮ�е��ܽ��
C.����ȡ����ˮ���������ܶȱ�ˮ��
D.����ѡ��CCl4���ƾ�����ȡ��
(6)ijѧ����һ�η�Һ�����з������²���Һ������ɫҺ�壬��֪����Һ©���е�Һ����һ�����л��㣬��һ����ˮ�㣬�����üķ����������������д���йز��輰�жϷ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס���ʵ��С���������ʵ��װ�÷ֱ��Ʊ�SnCl4��Ư�ۡ�
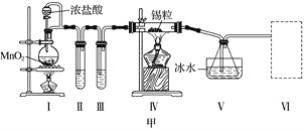
(1)��֪��a.�������۵�231 �棬��ѧ�������������ƣ�
b����������������ڽ�������Ӧ����SnCl4��SnCl4�ķе�114 ����
c��SnCl2��SnCl4����ˮ�⣬�������л��ܼ�����Sn2���ױ�����������ͼ��װ�ûش�
���Թܢ��е��Լ���____________________�����е��Լ���________________________��
�ڢ���װ�����ѡ��________(����ĸ)��
�ۢ�װ���з�Ӧ�����ӷ���ʽ��____________________________________________��
��ʵ�����������������װ�â���δ��Ӧ���MnO2����Ҫ�IJ���������______________��
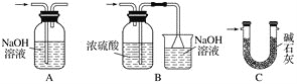
(2)��֪����Cl2�볱ʪ����ʯ�ҷ�Ӧ�Ƿ��ȷ�Ӧ�����¶Ƚϸ�ʱCl2�볱ʪCa(OH)2�ķ�ӦΪ6Cl2��6Ca(OH)2=Ca(ClO3)2��5CaCl2��6H2O��
����ͼ��װ�ûش𣺴�ʵ������Ca(ClO)2���ʽϵ͵�������
��________________________________________________________________________��
��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���ѡ����ȷ���ǣ� ��
A. 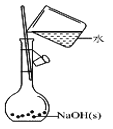 ����0.10mol/LNaOH��Һ
����0.10mol/LNaOH��Һ
B. 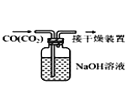 ��ȥCO�е�CO2
��ȥCO�е�CO2
C. 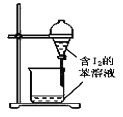 ����ȡ��ˮ�е�I2���ֳ�ˮ���IJ���
����ȡ��ˮ�е�I2���ֳ�ˮ���IJ���
D. 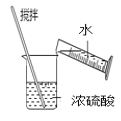 ϡ��Ũ����
ϡ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����е�����ʵ�飬ͼ1���ݲ�����ͼ2�����������н�����ȷ����

A.NaCl�Ƿǵ����B.NaCl�����в���������
C.NaCl��ˮ�е�����˿��������ƶ�������D.NaCl��Һ�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ�ϵ����CsHSO4����Ϊ����ʴ���H+��������ṹ����ͼ������ܷ�Ӧ�ɱ�ʾΪ��2H2+O2=2H2O�������й�˵����ȷ����
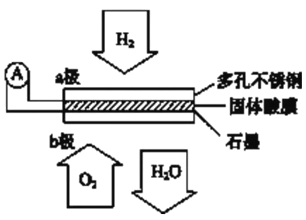
A. ����ͨ�����·��b������a��
B. b���ϵĵ缫��ӦʽΪ��O2+2H2O+4e--=4OH--
C. ÿת��0.1mol���ӣ�����1.12L��H2
D. H+��a��ͨ�����������ʴ��ݵ�b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ҵ����112 L����״��������������ʯ���鷴Ӧ���Ƶõ�Ư������Ч�ɷ�Ca��ClO��2�������Ϊ___________mol��
��2����һ����ʯ�����л���ͨ�����������ŷ�Ӧ�Ľ��У��¶����ߣ���ʼ����Ca��ClO3��2����ϵ��ClO����ClO3�������ʵ�����n���뷴Ӧʱ�䣨t���Ĺ�ϵ������ͼ1��ʾ��������������ˮ�ķ�Ӧ����
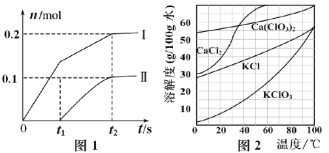
��t2ʱ�̺���Һ��ClO����ClO3�������ʵ���֮��Ϊ_____________��
�ڸ÷�Ӧ����������Ca��OH��2������Ϊ_____________��
��3����Ca��ClO3��2Ũ��Һ�м����Թ�����KCl�����ת��ΪKClO3����ͼ2���Ӹ���Һ�з����KClO3�����ʵ�鷽����________________����Ҫ�������������裩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. ��֪2CO(g)+O2(g)=2CO2(g) ��H= -566.0kJmol��1��÷�Ӧ�ķ�Ӧ��Ϊ566.0kJmol-1
B. �����ȼ���ȡ�H= -890kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽΪCH4(g)+O2(g)=CO2(g)+2H2O(g) ��H= -890kJmol-1
C. ��һ�������½�1mol SO2��0.5mol O2�����ܱ������г�ַ�Ӧ���ų�����79.2kJ����Ӧ���Ȼ�ѧ����ʽΪ2SO2(g)+O2(g)![]() 2SO3(g) ��H= -158.4kJmol-1
2SO3(g) ��H= -158.4kJmol-1
D. ��֪ϡ��Һ�У�H+(aq)+OH-(aq)=H2O(l) ��H= -57.3kJmol-1����ϡ������ϡ����������Һ��Ӧ����1molˮʱ�ų�������С��57.3kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com