
【题目】清洁能源氢气制取与储存是氢能源利用领域的研究热点.
已知:①CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H =+206.2kJ·mol-1
CO(g)+3H2(g) △H =+206.2kJ·mol-1
②CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) △H =+247.4kJ·mol-1
2CO(g)+2H2(g) △H =+247.4kJ·mol-1
③2H2S(g)![]() 2H2(g)+S2(g) △H =+169.8kJ·mol-1
2H2(g)+S2(g) △H =+169.8kJ·mol-1
请按要求回答下列问题
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________.
(2)在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体的平衡转化率与温度、压强的关系。
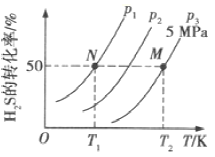
①图中压强(P1、P2、P3)的大小顺序为______,该反应平衡常数的大小关系为K(T1)_____填(“>”“<”或“=”)K(T2)。
②如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_________。
(3)硫化氢是剧毒气体,尾气中硫化氢有多种处理方法:
①碱溶液吸收。用150 ml 2.0 mol![]() L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
A.c()c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=c(OH-)+ c(HS-)+ c(S2-)
C.2c(Na+)=3[c(H2S)+c(HS-)+ c(S2-)]
D.c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
②纯碱溶液吸收,写出该吸收法发生反应的离子方程式_________________________。已知H2CO3和H2S在25℃时的电离常数如表所示:

③硫酸铜溶液吸收。200mL0.05 mol/ L的CuSO4溶液吸收液中H2S,恰好使反应溶液中Cu2+和S2-浓度相等的溶液中c(Cu2+)为___________________(已知常温下,Ksp(CuS)≈1.0×10-36)。
【答案】 CH4(g)+2H2O(g)═CO2(g)+4H2(g)△ H=+165.0kJ·mol-1 P1<P2<P3 < 及时分离出产物 AC CO32-+H2S=HCO3-+HS- 1.0×10-18mol·L-1
【解析】试题分析:(1)根据盖斯定律计算CH4与H2O(g)反应生成CO2(g)和H2(g)的焓变;(2) ①![]() ,增大压强平衡逆向移动;升高温度平衡正向移动;②根据影响平衡移动的因素分析;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离;②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS;③根据Ksp(CuS)≈1.0×10-36计算c(Cu2+);
,增大压强平衡逆向移动;升高温度平衡正向移动;②根据影响平衡移动的因素分析;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离;②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS;③根据Ksp(CuS)≈1.0×10-36计算c(Cu2+);
解析: ![]()
![]()
根据盖斯定律①![]() -②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△ H=+165.0kJ·mol-1;(2) ①
-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△ H=+165.0kJ·mol-1;(2) ①![]() ,增大压强平衡逆向移动,H2S气体的平衡转化率减小,根据图示,相同温度下,压强为P1、P2、P3时H2S气体的平衡转化率依次减小,所以压强的大小顺序为P1<P2<P3;升高温度平衡正向移动,平衡常数增大,所以K(T1)<K(T2);②根据影响平衡移动的因素,及时分离出产物,反应正向移动,H2S的转化率增大;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离,
,增大压强平衡逆向移动,H2S气体的平衡转化率减小,根据图示,相同温度下,压强为P1、P2、P3时H2S气体的平衡转化率依次减小,所以压强的大小顺序为P1<P2<P3;升高温度平衡正向移动,平衡常数增大,所以K(T1)<K(T2);②根据影响平衡移动的因素,及时分离出产物,反应正向移动,H2S的转化率增大;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离, ![]() ,故A正确;根据电荷守恒
,故A正确;根据电荷守恒![]() ,故B错误;根据物料守恒,等浓度的Na2S、NaHS溶液中
,故B错误;根据物料守恒,等浓度的Na2S、NaHS溶液中![]() ,故C正确;根据质子守恒,等浓度的Na2S、NaHS溶液中
,故C正确;根据质子守恒,等浓度的Na2S、NaHS溶液中![]() ,故D错误。②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS,反应的离子方程式是CO32-+H2S=HCO3-+HS-;③Ksp(CuS)= c(Cu2+)
,故D错误。②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS,反应的离子方程式是CO32-+H2S=HCO3-+HS-;③Ksp(CuS)= c(Cu2+)![]() c(S2-) ≈1.0×10-36, 溶液中Cu2+和S2-浓度相等,所以c(Cu2+)=1.0×10-18mol·L-1。
c(S2-) ≈1.0×10-36, 溶液中Cu2+和S2-浓度相等,所以c(Cu2+)=1.0×10-18mol·L-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应:SnCl2+H3AsO3+HCl(浓)→As+SnCl4+M,则正确的组合是( )
①H3AsO3被还原;②还原性:Cl->As;③M为电解质;④SnCl4是氧化产物;⑤每生成7.5gAs,还原剂失去的电子为0.3mol
A. ①③④⑤ B. ①④⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需KCl的质量为________g。
(2)在K2SO4和Al2(SO4)3的混合溶液中,测得Al3+的浓度为0.2molL﹣1,加入等体积0.6molL﹣1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中K+的浓度为_____molL﹣1。
(3)某固态化合物X受热分解的反应为:X=A↑+B↑+C↑,在一定的温度和压强下测得反应生成的混合气体对氢气的相对密度为15,则X的摩尔质量是___________。
(4)标准状况下,将V L A气体(摩尔质量为M molL﹣1)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为____________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。

回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B. 若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C. 铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N (H)∶N(N)=________________________。
(2)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)![]() F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)![]() H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
A. 当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B. 水电离的热化学方程式为:H2O(1)![]() H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C. 当c > 0.1时,一定不存在:c(Na+) = c(F—)
D. 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com