
同主族常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为HXO4<HYO4<HZO4,下列判断不正确的是
| A.单质氧化性:Y>Z | B.离子半径:X->Y- |
| C.气态氢化物稳定性:HX<HZ | D.Y单质可以在海水中提取 |
A
解析试题分析:根据最高价氧化物对应水化物中氢显+1价、氧显—2价,则X、Y、Z均显+7价,由于主族元素最高正价=主族序数,则X、Y、Z位于第VIIA族,由于氟无最高正价,则X、Y、Z属于卤素中常见的碘、溴、氯。Y、Z分别是溴、氯,根据元素周期律可得非金属性:Br<Cl,因此推断单质的氧化性:Br2<Cl2,故A选项错误;X、Y分别是碘、溴,碘离子的 电子层数大于溴离子,则离子半径:I->Br-,故B选项正确;X、Z分别是碘、氯,根据元素周期律可知,非金属性:I<Cl,由于非金属性越强气态氢化物越稳定,则稳定性:HI<HCl,故C选项正确;Y是溴,溴单质可以在海水中提取,海水中的溴离子可以被氧化为单质溴,故D选项正确。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质的综合推断等。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:单选题
有一个未完成的离子方程式: +XO3-+6H+=3X2+3H2O。据此判断下列说法中正确的是
| A.X可能是周期表中第二周期元素 |
| B.X元素的原子最外层上有7个电子 |
| C.X2是还原产物,H2O是氧化产物 |
| D.若生成3 mol X2,转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
| | | R | |
| T | Q | | W |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,不能肯定金属A 比金属 B的活泼性强的是( )
| A.A能与热水反应产生H2,B 必须与水蒸气反应才产生H2 |
| B.A和B都是元素周期表的主族金属元素,A在 B的左下方 |
| C.1mol A能从酸中置换出1.5molH2,1mol B能从酸中置换出1molH2 |
| D.A和B都是元素周期表的主族金属元素,B的最高价氧化物的水化物不溶于水且具有两性,能被A的最高价氧化物的水化物溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )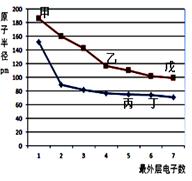
| A.丙的氢化物与丙的最高价氧化物的水化物能发生化合反应 |
| B.气态氢化物的稳定性:丙>丁>戊 |
| C.甲的离子半径比丁的简单离子半径小 |
| D.乙与丁形成的化合物含共价键,同时是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.共价化合物中只含共价键,离子化合物中只含离子键 |
| B.第三周期元素形成的氢化物稳定性从左到右逐渐增强 |
| C.短周期元素形成简单离子后,最外层电子数均达到8(或2)稳定结构 |
| D.在周期表过渡元素中寻找半导体材料,在金属与非金属分界处寻找催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层 数相等:Y能分别与X、Z形成原子个数比为1:3的化合物,常温下YX3是一种刺激性气味 的气体。下列说法正确的是
| A.原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B.W的氯化物水溶液中滴加过量Z与钠形成的饱和溶液,可生成W配合物 |
| C.由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D.已知YX3沸点远高于YZ3,则Y—X键的键能高于Y—Z键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为36,原子最外层电子数之和为14。其中A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。下列叙述正确的是
A. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
B. D元素处于元素周期表中第3周期第IVA族
C. A、C的最高价氧化物均为离子化合物
D. 四种元素的原子半径:A>B>D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com