

分析 (1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1;②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1,依据盖斯定律,①-②×3,计算反应热;
(2)①平衡常数等于生成物的浓度系数次幂之积除以反应物浓度系数次幂之积;
②根据温度对平衡移动的影响判断反应热的符号;
③曲线Ⅱ到达平衡所用时间较短,则该条件下温度高,升高温度平衡逆移;
(3)①用硫酸溶液作电解质进行电解,CO2失电子转化为甲烷;
②已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,所以碳酸氢根离子的水解能力强于铵根离子.
解答 解:(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依据盖斯定律,①-②×3得Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),故△H=489.0kJmol-1-3×172.5kJmol-1=-28.5kJmol-1,
故答案为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),其平衡常数K=$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$,故答案为:$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$;
②根据图象可知达到平衡后,温度越高,甲醇的体积分数φ(CH3OH)越小,说明升高温度平衡逆移,则正反应方向为放热反应,则△H<0,故答案为:<;
③根据图象可知曲线Ⅱ到达平衡所用时间较短,则该条件下温度高,升高温度平衡逆移,平衡常数减小,则曲线Ⅱ条件下平衡常数较小,即KⅠ>KⅡ;
故答案为:>;
(3)①用硫酸溶液作电解质进行电解,CO2失电子转化为甲烷,则其电极方程式为:CO2+8H+-8e-=CH4+2H2O,故答案为:CO2+8H+-8e-=CH4+2H2O;
②已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,所以碳酸氢根离子的水解能力强于铵根离子,所以 NH4HCO3显碱性,故答案为:碱性.
点评 本题综合性考查了盖斯定律的应用、平衡常数的表达式及影响因素的判断、电极方程式的书写等,侧重于对基础知识的综合应用的考查,题目难度中等,侧重于考查学生的分析能力和解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池放电时Li+向负极移动 | |
| B. | 电池放电时,正极的电极反应式为:2Li++Li2O2+2e-═2Li2O | |
| C. | 电池充电时,Li极应与外电源的正极相连 | |
| D. | 电池系统内进入二氧化碳及水对电池性能不会产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
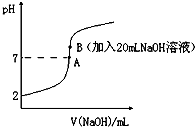 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑤ | C. | ③⑤⑥⑧ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 淀粉尚有部分未水解 | |
| B. | 淀粉已完全水解 | |
| C. | 淀粉没有水解 | |
| D. | 淀粉已发生水解,但不知是否水解完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com