
分析 由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,反应中只有N元素的化合价发生变化,NO易与空气中氧气反应生成红棕色的NO2气体,根据硝酸和转移电子之间的关系式计算;据此分析.
解答 解:①NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,
该反应中3NF3+5H2O=9HF+2NO+HNO3中,生成1molHNO3和转移电子2mol,所以若反应中生成0.1mol HNO3,转移的电子数目=0.1mol×2×NA/mol=0.2NA;
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.2NA;
②反应中生成NO,NO易与空气中氧气反应生成红棕色的NO2气体;
故答案为:泄漏处出现红棕色气体.
点评 本题考查含氮化合物的性质以及氧化还原反应,题目难度不大,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
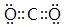 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程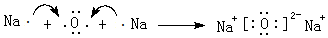 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
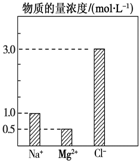 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

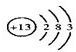 ; F的化学式FeCl2.
; F的化学式FeCl2.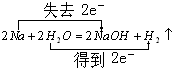 .反应②:
.反应②: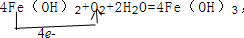 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 | |
| B. | Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 | |
| C. | Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 | |
| D. | NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com