
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 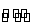 2G(g),忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g),忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
| 压强/MPa体积分数/%温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
①b<f
②915℃、2.0 MPa时E的转化率为60.0%
③该反应的ΔS>0
④K(1 000℃)>K(810℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
【解析】选A。从所给反应E(g)+F(s)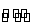 2G(g)可知,该反应是一个体积增大的反应,即ΔS>0,③正确;结合表中数据“54.0”“75.0”“83.0”,这个过程是压强增大(平衡向逆反应方向移动,G的体积分数减小)和温度升高的过程,所以温度升高平衡一定向正反应方向移动,正反应是吸热反应,即温度升高,化学平衡常数增大,④正确;根据以上分析,b小于54.0,f大于83.0,所以b<f,即①正确;设915℃、2.0 MPa时E的转化率为x,
2G(g)可知,该反应是一个体积增大的反应,即ΔS>0,③正确;结合表中数据“54.0”“75.0”“83.0”,这个过程是压强增大(平衡向逆反应方向移动,G的体积分数减小)和温度升高的过程,所以温度升高平衡一定向正反应方向移动,正反应是吸热反应,即温度升高,化学平衡常数增大,④正确;根据以上分析,b小于54.0,f大于83.0,所以b<f,即①正确;设915℃、2.0 MPa时E的转化率为x,
由 E(g) + F(s) 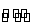 2G(g)
2G(g)
起始物质的量
浓度(mol·L-1) 1 0
转化物质的量
浓度(mol·L-1) x 2x
平衡物质的量
浓度(mol·L-1) 1-x 2x
则有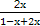 ×100%=75.0%,解得x=0.6,即E的转化率为60.0%,②正确。
×100%=75.0%,解得x=0.6,即E的转化率为60.0%,②正确。


科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
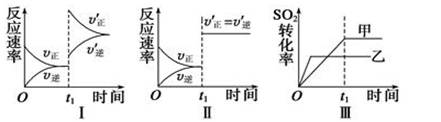
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则( )
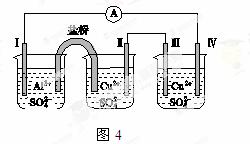
A.电流方 向:电极Ⅳ—→
向:电极Ⅳ—→ —→电极Ⅰ
—→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
某碱性蓄电池在充电和放电时发生的反应为:
Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
A.放电时,负极上发生反应的物质是Fe
B.放电时,正极反应是:NiO2+2e-+2H+===Ni(OH)2
C.充电时,阴极反应是:N i(OH)2-2e-+2OH-===NiO2+2H2O
i(OH)2-2e-+2OH-===NiO2+2H2O
D.充电时,阳极附近pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应A(s)+2B(g)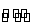 C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如下图所示。下列说法正确的是( )
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如下图所示。下列说法正确的是( )
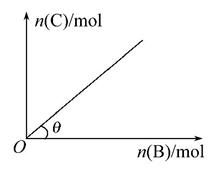
A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通入B,则反应混合物的温度升高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是
A.HCl+NaOH  NaCl+H2O B.SO3+H2O === H2SO4
NaCl+H2O B.SO3+H2O === H2SO4
C.2Na+Cl2 △ 2NaCl D.CaCO3  CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:① Z的原子序数为29,而Q、R、X、Y均为短周期主族元素;② R原子有3个未成对电子;③ Q、X原子p轨道的电子数分别为2和4;④ Y原子价电子(外围电子)排布为msnmpn。请回答下列问题:
(1)R的氢化物RH3中R采取______杂化,其键角_____109°28′(选填“>”、“=”或者“<”)。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是(选填字母代号)_____。
a.稳定性:甲>乙;沸点:甲>乙 b.稳定性:甲>乙;沸点:甲<乙
c.稳定性:甲<乙;沸点:甲<乙 d.稳定性:甲<乙;沸点:甲>乙
(3)下列与H2X分子互为等电子体的微粒有(选填字母代号) 。
a.CH4 b.H2S c.NO2 d.NH2-
(4)由X和Y形成的化合物属于________晶体(填晶体类型),30 g该晶体中有_____mol共价键。
(5)Z是 (填元素符号),它位于周期表的 区,其晶体的三维堆积模型见右图,称之为面心立方最密堆积,其配位数为 。Z2+的外围电子排布式是____________。1个Z2+与4个RH3以配位键结合形成_________________离子(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com