
| A. | Mg、Fe | B. | Zn、Ag | C. | Fe、Zn | D. | Mg、Al |
分析 标况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,若金属都是+2价,则混合金属的物质的量为为0.5mol,其平均摩尔质量为:$\frac{15g}{0.5mol}$=30g/mol,据此对各选项进行判断;注意Al为+2价金属时的摩尔质量为:$\frac{27g/mol}{3}$×2=18g/mol,Ag不与稀盐酸反应,其摩尔质量可以看作无穷大.
解答 解:标况下11.2L氢气的物质的量为0.5mol,若金属都是+2价,则混合金属的物质的量为为0.5mol,其平均摩尔质量为:$\frac{15g}{0.5mol}$=30g/mol,
A.Mg的摩尔质量为24g/mol,Fe的摩尔质量为56g/mol,二者平均摩尔质量可以为30g/mol,故A正确;
B.Zn的摩尔质量为65g/mol,Ag不与盐酸反应,其摩尔质量可以看作无穷大,则二者平均摩尔质量一定大于30g/mol,故B错误;
C.Fe的摩尔质量为56g/mol,Zn的摩尔质量为65g/mol,二者二者平均摩尔质量一定大于30g/mol,故C错误;
D.Mg的摩尔质量为24g/mol,Al为+2价金属时的摩尔质量为:$\frac{27g/mol}{3}$×2=18g/mol,二者平均摩尔质量一定小于30g/mol,故D错误;
故选A.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2分子的结构稳定,因而氮气不能支持任何物质的燃烧 | |
| B. | 液氨汽化时要吸收大量热,因而液氨可用作制冷剂 | |
| C. | NO可用向上排空气法或者排水法收集 | |
| D. | 浓硝酸保存在棕色瓶内是因为硝酸易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:l | B. | 8:9 | C. | 3:4 | D. | 6:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数为2NA | |
| C. | 标准状况下,2.24L庚烷含有的分子数为0.1NA | |
| D. | 1 mol Na2O2中含有的阴离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
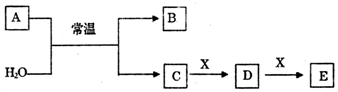
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al溶于某强酸失去2mol电子,一定产生2gH2 | |
| B. | 0.1mol肼(N2H4)中共用电子对教目为0.5NA | |
| C. | 64.0gSO2与足量O2生成SO3电子转移教为2NA | |
| D. | 2L0.5mol/L硫酸钾溶液阴离子电荷数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com