
| A | B | C | D |
 |  |  |  洗气瓶 |
| 快速制备少量NH3 | H2的尾气处理 | 测量NO的体积 | 除去乙烯中的SO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.图为固体与液体反应不加热装置,利用浓氨水与生石灰可制取氨气;
B.氢气无毒,具有可燃性,燃烧产物为水;
C.NO不溶于水,可利用排水法测定体积;
D.乙烯、二氧化硫均与溴水反应.
解答 解:A.使用该装置以及浓氨水和生石灰可快速制备少量NH3,故A正确;
B.H2属于可燃性气体,且燃烧产物无危害,可用点燃法处理尾气,故B正确;
C.NO不溶于水,可用量气管测量其体积,故C正确;
D.溴水不但与SO2反应,还会与乙烯发生加成反应,则图中装置不能除杂,故D错误.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备和收集、混合物分离提纯等,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的化合物不一定属于醇类 | |
| B. | 代表醇类的官能团是与链烃基相连的羟基 | |
| C. | 酚类和醇类具有相同的官能团 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中可能有离子键 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 离子化合物中可能有共价键 | |
| D. | 两个非金属原子间可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO失氧变为CaC2 | B. | C的状态发生了变化 | ||
| C. | Ca的化合价在反应前后发生了改变 | D. | C失去了电子,同时也得到了电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 mol Cl2通入H20中,生成NA个HC10分子 | |
| B. | 32 g硫在空气中燃烧,该反应转移6NA个电子 | |
| C. | 标准状况下,2.24 L CO气体中约含有1.4NA个质子 | |
| D. | 室温下,1 L pH=3的H2S04,溶液中,H2S04,电离出2×10 -3 NA个H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,电离能(I)数据依次为:I1=490kJ/mol-1,I2=4562kJ/mol-1,I3=6912kJ/mol-1… |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 在第四周期元素原子中,其所含不成对电子数最多 |
 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.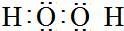 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com