
| A. | 体积相等,密度相等的CO和C2H4 | B. | 温度相同,体积相同的O2和N2 | ||
| C. | 质量相等,密度不等的N2和CO | D. | 压强相同、体积相同的N2和O2 |
分析 A.体积相等、密度相等的CO和C2H4的质量相等,二者摩尔质量相等,所以其物质的量相等,根据N=nNA知,其分子个数相等,结合分子构成判断原子个数是否相等;
B.温度相同、体积相同的O2和N2,影响气体分子数目的因素有压强,二者所处压强不一定相等;
C.氮气和一氧化碳的摩尔质量相等,质量相等时物质的量相等,根据N=nNA知,其分子个数相等,结合分子构成判断原子个数是否相等;
D.压强、体积相同条件下,影响气体分子数目的因素有温度,二者所处温度不一定相等.
解答 解:A.体积相等、密度相等的CO和C2H4的质量相等,二者摩尔质量相等,所以其物质的量相等,根据N=nNA知,其分子个数相等,CO和乙烯每个分子中所含原子个数不等,导致CO和乙烯中原子个数不等,故A错误;
B.温度相同、体积相同的O2和N2,影响气体分子数目的因素有压强,二者所处压强不一定相等,所以二者的物质的量不一定相等,则原子个数不一定相等,故B错误;
C.氮气和一氧化碳的摩尔质量相等,质量相等时物质的量相等,根据N=nNA知,其分子个数相等,氮气和CO每个分子中含有原子个数相等,所以二者总原子个数相等,故C正确;
D.压强、体积相同条件下,影响气体分子数目的因素有温度,二者所处温度不一定相等,所以其物质的量不一定相等,导致其原子个数不一定相等,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律及推论、原子数目的计算、常用化学计量计算等,难度中等,注意根据pV=nRT理解,注意结合分子构成分析解答.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用50mL 0.50 mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50 mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前加碘食盐主要添加的是KIO3 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 明矾可用于水的杀菌,消毒 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量的浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平秤取25.20g NaCl | |
| C. | 用100mL 量筒量取5.2mL 盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,将量取的浓盐酸倒入容量瓶中,加水稀释到刻度线即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
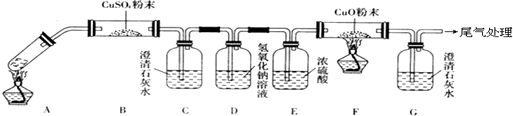
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com