
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
分析 n(CuSO4)=0.2mol,电解开始时阳极发生4OH--4e-=H2O+O2↑,阴极发生Cu2++2e-=Cu,转移0.4mol电子,而电解过程中转移电子数为0.6mol,说明铜离子完全放电后阴极还发生2H++2e-=H2,此时生成氢气时转移0.2mol电子,则生成0.1mol氢气,以此解答该题.
解答 解:n(CuSO4)=0.2mol,电解开始时阳极发生4OH--4e-=H2O+O2↑,阴极发生Cu2++2e-=Cu,转移0.4mol电子,而电解过程中转移电子数为0.6mol,说明铜离子完全放电后阴极还发生2H++2e-=H2,此时生成氢气时转移0.2mol电子,则生成0.1mol氢气,则阴极析出0.2molCu,0.1molH2,阳极析出0.15molO2,则应加入Cu2(OH)2CO3,
故选D.
点评 本题考查电解原理,为高频考点,侧重电极反应、原子守恒及转移电子计算的考查,注意把握电极反应以及电子转移的量的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物的热稳定性:HQ>HY | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况) | 50 | 120 | 232 | 290 | 310 |
| A. | 在0~1,1~2,2~3,3~4,4~5min时间段中,反应速率最大的时间是4~5段,因为在此段时间内生成气体最多 | |
| B. | 在2~3min时间段内,用盐酸浓度变化表示的反应速率为0.1mol•L-1min-1 | |
| C. | 在该稀盐酸中分别加入等体积的蒸馏水、Na2SO4溶液或Na2CO3溶液都能减缓反应速率且不减少产生氢气的量 | |
| D. | 为了加快该化学反应速率,可以向其中加入MgSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
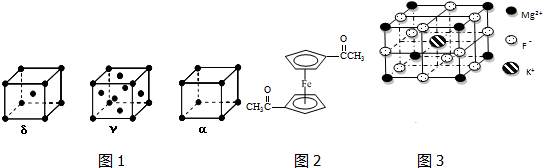
 .已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.
.已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H6+C2H5Cl→C6C5-C2H5+HCl | |
| B. | C6H6+C2H5OH→C6H5-C2H5+H2O | |
| C. | C6H6+CH2=CH2→C6H5-C2H5 | |
| D. | C6H5-CH2CH2Br→C6H5-CH=CH2+HBr;C6H5-CH=CH2+H2→C6H5C2H5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com