
| A、用广泛pH试纸测得氯水的pH为2 |
| B、用托盘天平称取10.50g干燥的NaCl固体 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高 |
| D、制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液时,胶头滴管不能伸入液面以下 |
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在25℃时,若溶液呈中性,则pH=7,AG=1 |
| B、在25℃时,若溶液呈酸性,则pH<7 AG<0 |
| C、在25℃时,若溶液呈碱性,则pH>7 AG>0 |
| D、在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
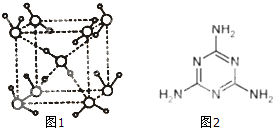 聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.查看答案和解析>>
科目:高中化学 来源: 题型:
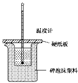 某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )
某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D、酸或碱的物质的量越大,所测中和热的数值越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 1.44 | 9.6 | 9.6 |
| 催化剂 |
| n(H2) |
| n(CO2) |
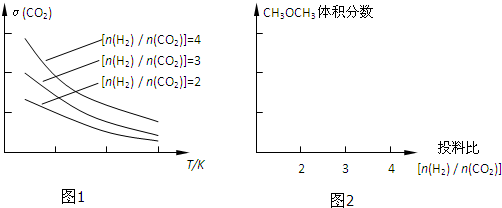
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |  | |
| 步 骤 2 | 第①份 试液 |  | 碘盐中肯定含 |
| 第②份 试液 |  |  | |
| 第③份 试液 |  | X为 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com