
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
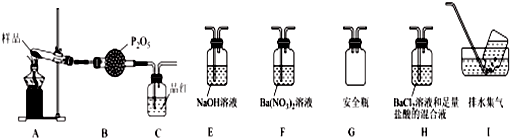
分析 (1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质是盐中亚铁离子被氧化为铁离子,依据铁离子的检验方法选择试剂检验莫尔盐是否变质;
(2)①K2Cr2O7溶液中溶质为强氧化剂,能氧化橡胶管;
②酸性溶液中亚铁离子被重铬酸钾氧化为铁离子,重铬酸钾被还原为铬离子,结合原子守恒和电荷守恒配平书写离子方程式;
③图表数据中Ⅱ数据误差较大舍去,计算平均消耗溶液体积,结合离子方程式定量关系计算得到溶液浓度;
(3)①摩尔盐中N为-3价,Fe为+2价,S为+6价,根据产物中化合价分析;
②(NH4)2Fe(SO4)2•6H2O受热分解的固体为红色固体,依据盐中元素守恒分析判断,红色固体为氧化铁,品红溶液褪色是二氧化硫的特征性质,二氧化硫是酸性氧化物,二氧化硫有毒污染空气,需要尾气吸收,用氢氧化钠溶液吸收;
③验证固体分解生成的气体中生成氨气,用碱石灰干燥气体除去酸性氧化物气体,氨气溶于水反应生成的是一水合氨溶液,一水合氨电离出氢氧根离子溶液显碱性;
④莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明,利用装置A连接装置G安全瓶防止倒吸,通过装置H中的氯化钡溶液和盐酸混合溶液生成白色沉淀硫酸钡,证明生成三氧化硫.
解答 解:(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质是盐中亚铁离子被氧化为铁离子,检验莫尔盐是否变质的试剂是KSCN溶液,加入KSCN溶液后溶液变红色证明被氧化,若不变红色证明未被氧化,
故答案为:KSCN溶液;
(2)①K2Cr2O7溶液中溶质为强氧化剂,能氧化橡胶管,不能盛放在碱式滴定管中,应盛放在酸洗滴定管中,故答案为:酸;
②准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点,酸性溶液中亚铁离子被重铬酸钾氧化为铁离子,重铬酸钾被还原为铬离子,反应的离子方程式为:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O,
故答案为:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O;
③图表数据中Ⅱ数据误差较大舍去,计算平均消耗溶液体积V=$\frac{22.58-2.5+19.92}{2}$ml=20ml,设重铬酸钾溶液浓度为c,
6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O
6 1
$\frac{m}{392}$mol 0.020L×c
c=$\frac{m}{47.04}$mol/L,
故答案为:$\frac{m}{47.04}$;
(3)①N2、Fe2O3,SO3、H2O反应时有Fe元素的化合价升高,氮元素化合价升高,无元素化合价降低不符合氧化还原反应规律,
故答案为:不同意,N、Fe的化合价均升高,没有化合价降低的元素;
②(NH4)2Fe(SO4)2•6H2O受热分解的固体为红色固体,依据盐中元素守恒分析判断,红色固体只能为氧化铁,品红溶液褪色是二氧化硫的特征性质,C装置中红色褪去,说明气体产物中含有二氧化硫,二氧化硫是酸性氧化物,二氧化硫有毒污染空气,需要尾气吸收,用氢氧化钠溶液吸收,
故答案为:Fe2O3;SO2;NaOH溶液;
③利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B干燥管中用碱石灰吸收水蒸气、生成的二氧化硫或三氧化硫,C装置中是酚酞溶液,气体通入会变红色,证明生成的气体为氨气,
故答案为:碱石灰;酚酞溶液;
④要检验生成SO3(g)、N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、H、I;
故答案为:G、H、I.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 5 mol | C. | 196g | D. | 98g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com