
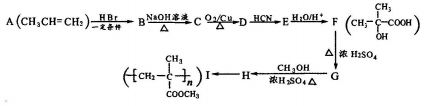
分析 D的核磁共振氢谱只有1组峰,可知D中只有一种H,则A与HBr发生加成反应生成B为CH3CHBrCH3,B发生水解反应生成C为CH3CHOHCH3,C发生催化氧化生成D为(CH3)2C=O,D与HCN发生加成反应生成E为(CH3)2CHOHCN,结合信息可知,E→F中-CN转化为-COOH,F发生消去反应生成G为CH2=C(CH3)COOH,G与甲醇发生酯化反应生成H为CH2=C(CH3)COOCH3,H发生加聚反应生成I,以此来解答.
解答 解:(1)F中官能团的名称为羟基、羧基,G→H的反应类型为酯化反应或取代反应,B为CH3CHBrCH3,其名称(系统命名)是2-溴丙烷,
故答案为:羟基、羧基;酯化反应或取代反应;2-溴丙烷;
(2)B→C的化学反应方程式为CH3CHBrCH3+NaOH$→_{△}^{H_{2}O}$CH3CHOHCH3+NaBr,
故答案为:CH3CHBrCH3+NaOH$→_{△}^{H_{2}O}$CH3CHOHCH3+NaBr;
(3)E的结构简式为(CH3)2CHOHCN,故答案为:(CH3)2CHOHCN;
(4)H为CH2=C(CH3)COOCH3,同分异构体符合①能发生银镜反应,含-CHO,②能使溴的四氯化碳溶液褪色,含碳碳双键,③能使含有酚酞的NaOH溶液褪色,含-COOH或HCOOC-,有HCOOCH2CH2CH=CH2、HCOOCH2CH=CHCH3、HCOOCH=CHCH2CH3、HCOOC(CH2CH3)=CH2、HCOOC(CH3)=CHCH3、HCOOCH(CH3)CH=CH2、HCOOCH=C(CH3)2、HCOOCH2C(CH3)=CH2,其中磁共振氢谱只有3组峰的结构简式为HCOOCH=C(CH3)2,
故答案为:8;HCOOCH=C(CH3)2.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物结构与性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  用装置量取 15.00ml 的 NaOH 溶液 | |
| B. |  用装置制备 Cl2 | |
| C. |  装置用于除去 CO2中的HCl | |
| D. |  关闭活塞 a,从 b处加水,以检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
| 实验方案 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
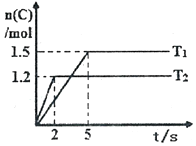 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )| A. | T1<T2 | |
| B. | 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等 | |
| C. | 温度为T2时,2s内B的平均速率为0.3mol•L-1•s-l | |
| D. | 温度为T1时,达平衡时反应物A的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应2A(s)+B(g)?2C(g)△H>0 能自发进行,原因是△S<0 | |
| B. | 催化剂能改变反应的途径,但不能改变反应的△H | |
| C. | S(g)+O2(g)═SO2(g)△H1<0 S(s)+O2(g)═SO2(g)△H2<0 则△H1>△H2 | |
| D. | 化学平衡CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),增加H2O的浓度H2O的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 解释或结论 | |
| A | 充分浸透了 Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可用作木材防火剂 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中有Na+、无K+ |
| C | 分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫 | 溶液颜色都变淺 | 说明氯气和二氧化硫都有 漂白性 |
| D | 向某加碘食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加 KIO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com