
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、向Ag2CrO4的浊液中加入AgNO3溶液,Ag2CrO4的Ksp减小 |
| B、将0.001 mol?L-1的AgNO3溶液逐滴加入到含Cl-和CrO42-浓度均为0.001 mol?L-1的溶液中,则先产生AgCl沉淀 |
| C、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| D、该温度下,AgCl在水中的溶解度小于在食盐水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ksp与温度有关 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C、向AgCl沉淀的溶解平衡中加入NaCl固体,AgCl平衡不移动 |
| D、若在Ca(OH)2溶液与FeCl2溶液中加足量稀硝酸,无沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、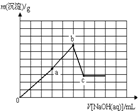 |
B、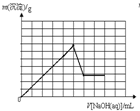 |
C、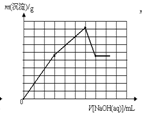 |
D、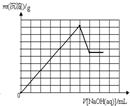 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恰好形成Ag2CrO4饱和溶液 |
| B、能析出Ag2CrO4沉淀 |
| C、不能析出Ag2CrO4沉淀 |
| D、无法确定能否析出Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
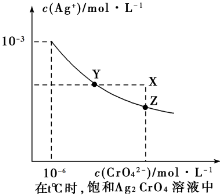
| A、在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B、在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C、在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/LKCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
| D、在t℃时,反应Ag2CrO4(s)+2 Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
查看答案和解析>>
科目:高中化学 来源: 题型:
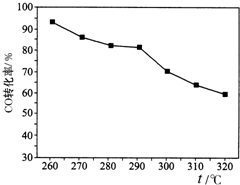 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com