下列说法正确的是( )
A.P和S属于第三周期元素,P原子半径比S小
B.Na和Rb属于第IA族元素,Rb失电子能力比Na强
C.C和si属于第IVA族元素,SiH4比CH4稳定
D.Cl和Br属于第VIIA族元素,HClO4酸性比HBrO4弱
【答案】分析:A、同周期主族元素,随原子序数增大,原子半径减小.
B、同主族元素,随电子层增多,金属性增强.
C、非金属性越强,对应氢化物越稳定,同主族自上而下金属性增强,非金属性减弱.
D、非金属性越强,最高价氧化物对应水合物的酸性越强,同主族自上而下金属性增强,非金属性减弱.
解答:解:A、P和S属于第三周期元素,核电荷数P<S,所以原子半径P>S,故A错误;
B、Na和Rb属于第IA族元素,原子半径Na<Rb,Rb失电子能力比Na强,故B正确;
C、C和si属于第IVA族元素,非金属性C>si,所以CH4比SiH4稳定,故C错误;
D、Cl和Br属于第VIIA族元素,非金属性Cl>Br,HClO4酸性比HBrO4强,故D错误.
故选:B.
点评:考查元素性质的递变规律、原子结构与性质关系,难度不大,注意元素周期律的理解运用.



 阅读快车系列答案
阅读快车系列答案
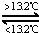 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,