

分析 (1)反应物的总能量大于生成物的总能量时,反应放热;
(2)①根据反应速率V=$\frac{\frac{△n}{V}}{△t}$求出氨气的反应速率,然后根据反应速率之比等于计量数之比求出氮气的反应速率;根据△n之比等于计量数之比,求出氢气的物质的量的改变量△n,然后求出10min后氢气的物质的量,即可求出氢气的浓度;
②当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断;
(3)根据图示可知,此燃料电池为酸性甲烷燃料电池,而正极上氧气放电,据此写出电极反应方程式;当1mol氧气放电时,放电4mol电子,据此计算.
解答 解:(1)从图示可知,反应物的总能量大于生成物的总能量,故反应放热,故答案为:放热;
(2)①氨气的反应速率V(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1mol}{5L}}{10min}$=0.02mol/(L•min),反应速率之比等于计量数之比,故氮气的反应速率V(N2)=0.01mol/(L•min);由于△n之比等于计量数之比,故氢气的物质的量的改变量△n(H2)=$\frac{3}{2}△{n}_{(N{H}_{3})}$=$\frac{3}{2}×1mol$=1.5mol,故10min后氢气的物质的量n(H2)=3mol-1.5mol=1.5mol,即氢气的浓度C(H2)=$\frac{1.5mol}{5L}$=0.3mol/L,故答案为:0.01mol/(L﹒min);0.3mol/L;
②A.由于反应是可逆反应,故容器内N2、H2、NH3三种气体一直共存,与平衡不平衡无关,即不能说明反应达平衡,故A错误;
B.单位时间内生成nmolN2则意味着消耗掉2nmolNH3,而同时生成2nmolNH3,则说明反应达平衡,故B正确;
C.N2、H2、NH3的分子数之比为1:3:2时反应不一定平衡,达平衡时N2、H2、NH3的分子数之比也不一定为1:3:2,故C错误;
D.由于是恒容的容器,且此反应正反应方向为气体的物质的量减小的方向,故当反应未达平衡时,容器中的压强在减小,故当容器中气体的压强保持不变时,说明反应达平衡,故D正确.
故选BD.
(3)根据图示可知,此燃料电池为酸性甲烷燃料电池,而正极上氧气放电,故正极的电极反应方程式为:O2+4e-+4H+═2H2O;当1mol氧气放电时,放电4mol电子,故电路中每通过3.01×1024个电子即5mol电子时,正极上放电的氧气的物质的量为n=$\frac{5}{4}$mol,在标况下体积为V=$\frac{5}{4}$mol×22.4L/mol=28L.故答案为:O2+4e-+4H+═2H2O;28;
点评 本题考查了反应吸放热的判断、化学反应速率的求算以及反应是否达平衡的判断和电极反应方程式的书写等,综合性较强但难度不大.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
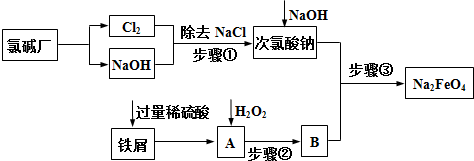
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
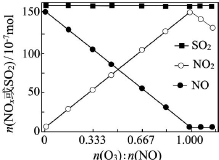 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 金属性:Al>Mg | ||
| C. | 热稳定性:H2O>H2S | D. | 酸性:H3PO4>H3AsO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
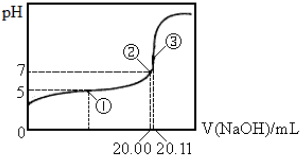
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
室温时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | pH=4 的溶液中:c(Na+)+c(H+)-c(OH-)=0.1-c(CH3COOH) | |
| B. | W点表示的溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | pH=5的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)>c(CH3COOH)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com