
| 光照 |
| 光照 |
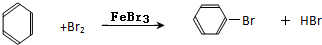 ,
,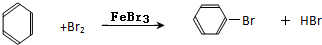 ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 | ||
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 | ||
C、用试管夹从试管底由下往上夹住距离管口约
| ||
| D、把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、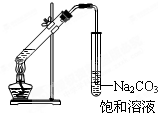 实验室常用如图所示的装置制取少量的乙酸乙酯 |
| B、用热的纯碱溶液洗涤试管内壁附着的油脂 |
| C、棉花在酒精灯的火焰上灼烧后会产生烧焦羽毛味 |
| D、用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com