


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca2++2ClO-=CaCO3↓+2HClO |
| B、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-=CO32-+H2O |
| C、Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl2溶液中通入Cl22Fe2++Cl2=2Fe3++2Clˉ |
| B、FeCl3溶液跟过量氨水 Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+ |
| C、碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| D、钠与水的反应 2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 升高温度,平衡常数减小 |
B、 0~3内,反应速率为v(NO2)=0.2mol?L-1 |
C、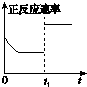 t1时仅加入催化剂,平衡正向移动 |
D、 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
| B、NH5中既有共价键又有离子键 |
C、NH5的电子式为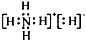 |
| D、它与水反应的离子方程式为NH4++H-+H2O=NH3?H2O+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com