
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
分析 由于蒸馏时必须有冷凝管冷却气体,所以根据所给的仪器可知,缺少冷凝管,所以不能进行蒸馏实验.
解答 解:所给仪器中有铁架台、铁圈、玻璃棒、蒸发皿、酒精灯、火柴,故可进行蒸发操作;所给仪器中有铁架台、铁圈、漏斗、滤纸、玻璃棒、烧杯,可进行过滤操作;所给仪器中有分液漏斗,可进行萃取;蒸馏时必须用冷凝管,而所给仪器中无冷凝管,故不能进行蒸馏实验,
故选D.
点评 化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容在高考命题中一方面是单独命题,另一方面是出现在综合实验试题中,就前者来说,今后仍然是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用的能力.


科目:高中化学 来源: 题型:选择题
| A. | 在电解水实验中,加入硫酸钠可以提高电解效率 | |
| B. | 碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成 | |
| C. | 铁制品在海水中比在纯水中更易腐蚀 | |
| D. | 在双氧水中加FeCl3溶液可使产生O2速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1s22s22p3 | B. | 1s22s22p63s23p63d34s2 | ||
| C. | 1s22s22p63s23p6 | D. | 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
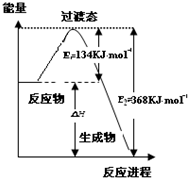 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
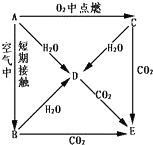 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com