
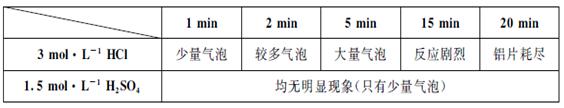
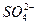 对该反应不影响。
对该反应不影响。 出主要实验步骤。
出主要实验步骤。
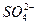 是否对反应起作用。若速率减小,说明
是否对反应起作用。若速率减小,说明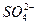 对该反应有抑制作用;若速率不变,说明
对该反应有抑制作用;若速率不变,说明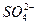 对该反应的速率不影响。(3分)
对该反应的速率不影响。(3分)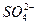 对金属铝与H+反应有抑制作用”或“
对金属铝与H+反应有抑制作用”或“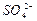 对金属铝与H+反应没有影响”或“带低电荷的阴离子对金属铝与H+反应有促进作用”等等。
对金属铝与H+反应没有影响”或“带低电荷的阴离子对金属铝与H+反应有促进作用”等等。

科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.①③⑤ | C.①③④⑤ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度 | B.催化剂 | C.反应物的接触面积 | D.反应物的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率乙>甲 | B.平衡后O2浓度乙>甲 |
| C.SO2转化率乙>甲 | D.平衡后SO2的体积分数乙>甲 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化钠溶液 | B.水 | C.醋酸钾溶液 | D.硫酸铜固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.一定温度下,反应MgCl2( l)=Mg(l)+ Cl2(g)的△H>0△S>0 l)=Mg(l)+ Cl2(g)的△H>0△S>0 |
| B.Cl2在饱和食盐水中溶解度比纯水中小无法用勒夏特列原理去解释 |
C.对于反应2 H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
| D.过程的自发性的作用是确定过程是否一定会发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 “向逆反应方向”或“不”)移动,N2的转化率_________。
“向逆反应方向”或“不”)移动,N2的转化率_________。 (选填序号字母)。
(选填序号字母)。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | H2O2的浓度(质量分数) | 温度(℃) | 催化剂的使用 |
| A | 2 | 10 | 使用MnO2 |
| B | 4 | 10 | 不使用 |
| C | 6 | 30 | 使用MnO2 |
| D | 6 | 30 | 不使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com