
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2B. BF3与NH3C. BeCl2与SCl2D. H2O与CH4
【答案】D
【解析】
ABm型杂化类型的判断:
公式:电子对数n=![]() (中心原子的价电子数+配位原子的成键电子数±电荷数)
(中心原子的价电子数+配位原子的成键电子数±电荷数)
注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”;
②当配位原子为氧原子或硫原子时,成键电子数为零。
根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化。
A. CO2中C原子杂化轨道数为![]() ×(4+0)=2,采取sp杂化方式,SO2中S原子杂化轨道数为
×(4+0)=2,采取sp杂化方式,SO2中S原子杂化轨道数为![]() ×(6+0)=3,采取sp2杂化方式,中心原子杂化轨道的类型不同,故A错误;
×(6+0)=3,采取sp2杂化方式,中心原子杂化轨道的类型不同,故A错误;
B. NH3中N原子杂化轨道数为![]() ×(5+3)=4,采取sp3杂化方式,BF3中B原子杂化轨道数为
×(5+3)=4,采取sp3杂化方式,BF3中B原子杂化轨道数为![]() ×(3+3)=3,采取sp2杂化方式,中心原子杂化轨道的类型不相同,故B错误;
×(3+3)=3,采取sp2杂化方式,中心原子杂化轨道的类型不相同,故B错误;
C. BeCl2中Be原子杂化轨道数为![]() (2+2)=2,采取 sp杂化方式,SCl2中S原子杂化轨道数为
(2+2)=2,采取 sp杂化方式,SCl2中S原子杂化轨道数为![]() (6+2)=4,采取 sp3杂化方式,中心原子杂化轨道的类型不同,故C错误;
(6+2)=4,采取 sp3杂化方式,中心原子杂化轨道的类型不同,故C错误;
D. CH4中C原子杂化轨道数为![]() ×(4+4)=4,采取sp3杂化方式,H2O中O原子杂化轨道数为
×(4+4)=4,采取sp3杂化方式,H2O中O原子杂化轨道数为![]() ×(6+2)=4,采取sp3杂化方式,中心原子杂化轨道的类型相同,故D正确;
×(6+2)=4,采取sp3杂化方式,中心原子杂化轨道的类型相同,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
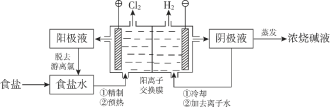
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
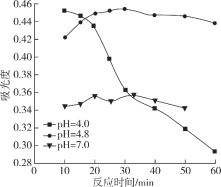
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法不正确的是( )
A. 实验室用H2O2分解制O2,加MnO2做催化剂后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用锌和盐酸反应制取氢气,用锌粉比锌粒反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2![]() 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
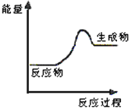
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
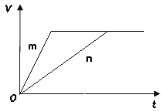
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c(![]() )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
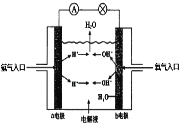
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则![]() 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质属于同素异形体________;属于同位素是________;属于同一种物质是________;属于同系物是________。(写序号)
①红磷与白磷;②12C与14C;③S2与S8;④235U与238U;⑤干冰与二氧化碳;⑥CH4与CH3CH3;⑦ ![]() 与
与 ![]() ;⑧CH3CH=CH2和CH2=CH2。
;⑧CH3CH=CH2和CH2=CH2。
(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,请写出工业上用A制备酒精的化学方程式________。
(3)在一定体积的 18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为 0.9 mol。则浓硫酸的实际体积________ (填“大于”“小于”或“等于”)100 mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如 KNO3溶液),则该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计的糖厂甘蔗渣利用方案如下图所示:其中:A是植物生长调节剂,B是高分子化合物,D是具有水果香味的物质。请回答以下问题:
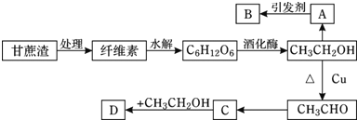
(1)纤维素的化学式为________,是________(填“纯净物”或“混合物”)。
(2)B的结构简式为________,C中官能团的名称为________。
(3)写出下列转化的化学方程式:CH3CH2OH→CH3CHO:_______,反应类型为________。
(4)化学式为C5H10O2的同分异构体中是C的同系物的有______种,其中在核磁共振氢谱上只有2个峰,且峰面积之比为1:9的结构简式为_______。
(5)下列说法正确的是________(填字母)。
A.生产A的主要方法是石油裂解,其产量是衡量一个国家石油化工水平的标志之一
B.分馏石油得到的各个馏分为纯净物
C.B可用于制造食品包装袋
D.塑料、合成纤维、合成橡胶等都是合成有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com