
| A. | 消耗氧气的体积为1.68 L | |
| B. | 混合气体中含NO21.12 L | |
| C. | 此反应过程中转移的电子为0.3 mol | |
| D. | 参加反应的硝酸是0.4mol |
分析 标况下2.24L混合气体的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则n(NO2)+n(NO)=0.1,得失电子守恒知:n(NO2)+3n(NO)=0.2,4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,反应消耗的铜的物质的量为4mol•L-1×50×10-3L×$\frac{1}{2}$=0.1mol,0.1mol铜完全反应失去0.2mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,根据电子守恒计算出消耗氧气物质的量,由此分析解答.
解答 解:标况下2.24L混合气体的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则n(NO2)+n(NO)=0.1,得失电子守恒知:n(NO2)+3n(NO)=0.2,解得n(NO2)=0.05mol,n(NO)=0.05mol,4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,反应消耗的铜的物质的量为4mol•L-1×50×10-3L×$\frac{1}{2}$=0.1mol,0.1mol铜完全反应失去0.2mol电子,
A、消耗氧气的体积为$\frac{0.2}{4}$×22.4=1.12 L,故A错误;
B、因为n(NO2)=0.05mol,所以V(NO2)=0.05mol×22.4L/mol=1.12 L,故B正确;
C、此反应过程中转移的电子为0.2 mol,故C错误;
D、参加反应的硝酸是0.1mol+0.2mol=0.3mol,故D错误;
故选B.
点评 本题考查了有关离子反应的计算,题目难度中等,明确铜过量及发生反应原理为解答关键,转移电子守恒、质量守恒在化学计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
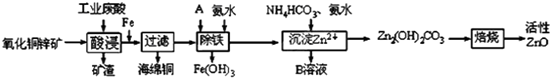
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com