
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 灼烧干海带至完全变成灰烬--坩埚 | |
| C. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
科目:高中化学 来源: 题型:选择题
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
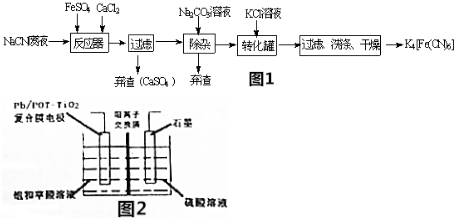
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、Mg2+、AlO${\;}_{2}^{-}$、NO${\;}_{3}^{-}$可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 通入H2S气体无明显现象,原因是二者不反应 | |
| D. | 与少量Ba(OH)2溶液反应的离子方程式:Al3++2SO${\;}_{4}^{2-}$+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
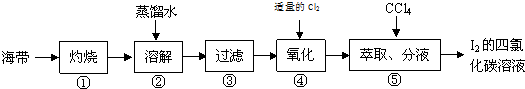
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
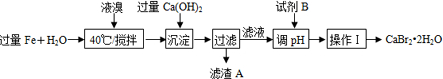
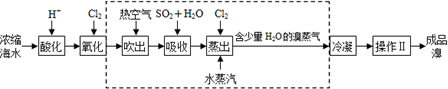
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
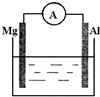 如图所示装置:
如图所示装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com