
【题目】异戊二烯是重要的有机化工原料,其结构简式为 ![]() 。
。
异戊二烯的一种制备方法如图所示:
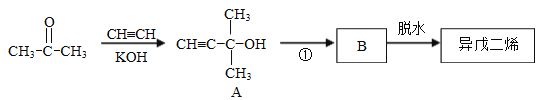
请回答:
(1)A分子中官能团的名称是_______。
(2)①的反应类型是_______。
(3)B的结构简式为___________________________。
(4)写出在一定条件下由异戊二烯制备聚异戊二烯的化学方程式_____________。
(5)设计一条由异戊二烯制得有机合成中间体![]() 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
_____________________________________________________________________
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:

己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代.如:
![]()
(1)B为芳香烃.
①由B生成对孟烷的反应类型是__.
②(CH3)2CHCl与A生成B的化学方程式是__.
③A的同系物中相对分子质量最小的物质是__.
(2)1.08g的C与饱和溴水完全反应生成3.45g白色沉淀.E不能使Br2的CCl4溶液褪色.
①F的官能团是__.
②C的结构简式是__.
③反应I的化学方程式是__.
(3)下列说法正确的是(选填字母)__.
a.B可使酸性高锰酸钾溶液褪色 b.C不存在醛类同分异构体
c.D的酸性比E弱 d.E的沸点高于对孟烷
(4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1.G与NaHCO3反应放出CO2.反应II的化学方程式是__.
(5)芳香族化合物W是C的同分异构体,则W的结构有__种(不含C的结构).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业制取Na2SO3固体的过程如下:

已知:① 反应I在三颈烧瓶中发生,装置如图甲所示(固定及加热类仪器省略)。
② 部分物质的溶解度曲线如图乙所示,其中Na2SO3饱和溶液低于50℃时析出Na2SO3·7H2O。
(l)反应I的目的是制取(NH4)2SO3溶液。

① 反应I的离子方程式为____________。
② 亚硫酸分解产生的SO2须冷却后再通入氨水中,目的是____________。
③ 下列关于图甲装置或操作的叙述正确的是______(填字母)。
A.接入冷凝管的冷却水从a端通入
B.长玻璃导管具有防倒吸的作用
C. 控制加热亚硫酸的温度,可以控制生成SO2气体的速率
(2)为获取更多的Na2SO3固体,要将反应II的温度控制在80℃左右,并_______(填操作I的名称)。
(3)由滤液可以制取NH4Cl固体。
①验证滤液中含有NH4+的实验操作是________。
②由滤液可获得NH4Cl粗产品(含少量Na2SO3)。请补充完整由NH4Cl粗产品制取纯净的NH4Cl固体的实验方案:________,得到纯净的NH4Cl固体。(实验中须使用的试剂有SO2、乙醇,除常用仪器外须使用的仪器有:真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。
B极区电解液为__________溶液(填化学式),阳极电极反应式为_________________________,
电解过程中Li+向 __________电极迁移(填“A”或“B”)。

(Ⅱ)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________极。
请写出负极的电极反应方程式:__________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是( )
A. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B. NH4+为正四面体结构,可推测PH4+也为正四面体结构
C. CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D. 金刚石熔化时需要破坏共价键,可推测C60熔化时也破坏共价健
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com