
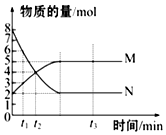
 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:分析 (1)根据图象知,反应达到平衡状态时,△n(N)=(8-2)mol=6mol,△n(M)=(5-2)mol=3mol,相同时间内不同物质的物质的量变化量之比等于其计量数之比;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率=$\frac{\frac{△n}{V}}{△t}$;
(3)t1时N的转化率=$\frac{(8-6)mol}{8mol}$×100%;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变.
解答 解:(1)根据图象知,反应达到平衡状态时,△n(N)=(8-2)mol=6mol,△n(M)=(5-2)mol=3mol,相同时间内不同物质的物质的量变化量之比等于其计量数之比,所以N、M的计量数之比=6mol:3mol=2:1,
故答案为:2:1;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{4-3}{V}}{{t}_{2}-{t}_{1}}$mol/(L.min)=$\frac{1}{({t}_{2}-{t}_{1})V}$mol/(L.min),
故答案为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol/(L.min);
(3)t1时N的转化率=$\frac{(8-6)mol}{8mol}$×100%=25%,
故答案为:25%;
(4)①单位时间内生成n molH2 的同时生成n mol HI,同时生成消耗0.5nmol氢气,正逆反应速率不相等,反应没有达到平衡状态,故错误;
②一个H-H 键断裂的同时有两个H-I键断裂,同时生成一个H-H键,正逆反应速率相等,反应达到平衡状态,故正确;
③质量分数:w(HI)=w(I2),该反应可能达到平衡状态,也可能没有达到平衡状态,与反应初始浓度及转化率有关,故错误;
④容器内HI(g)、H2 (g)、I2 (g)共存时该反应不一定达到平衡状态,故错误;
⑤c(HI):c(H2):c(I2)=2:1:1,该反应可能达到平衡状态,也可能没有达到平衡状态,与反应初始浓度及转化率有关,故错误;
⑥温度和体积一定时,容器内压强始终不变,不能据此判断平衡状态,故错误;
⑦温度和体积一定时,HI(g)浓度不再变化,正逆反应速率相等,反应达到平衡状态,故正确;
⑧温度和压强一定时,混合气体的平均摩尔质量始终不变,不能据此判断平衡状态,故错误;
⑨温度和压强一定时,混合气体的颜色不再发生变化,正逆反应速率相等,反应达到平衡状态,故正确;
⑩温度和压强一定时,容器体积与气体物质的量成正比,反应前后气体总物质的量不变,所以容器体积不变,则密度始终不变,不能据此判断平衡状态,故错误;
故选:②、⑦、⑨.
点评 本题考查图象分析及化学平衡有关知识,为高频考点,明确化学平衡状态特征、化学反应速率计算方法是解本题关键,注意化学平衡状态判断依据的正确选取,题目难度不大.


科目:高中化学 来源: 题型:选择题
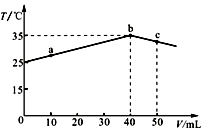
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
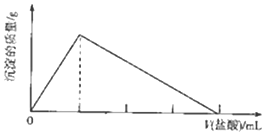 短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )| A. | 气态氢化物的稳定性:X>R | |
| B. | 简单离子半径:X>Y>Z | |
| C. | R的最高价氧化物对应的水化物是一种强酸 | |
| D. | 用Z的单质与Y的氧化物反应可冶炼Y的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com