
| A. | I2与Cl2反应的离子方程式为:I2+5Cl2+6H2O=2IO3-+12H++10Cl- | |
| B. | 当a=3b时,发生反应的离子方程式为:I-+3Cl2+3H2O=IO3-+6Cl-+6H+ | |
| C. | 当a=2b时,发生反应的离子方程式为:5I-+10Cl2+9H2O=3IO3-+20Cl-+I2+18H+ | |
| D. | 若反应后溶液中I2与IO3-的物质的量之比为1:1,则反应中转移电子3.5bmol |
分析 向KI溶液中通入过量Cl2时,生成的I2可进一步氧化成IO3-,若只氧化碘离子反应离子方程式为:Cl2+2I-=I2+2Cl-,若氯气过量反应为I2+5Cl2+6H2O=2IO3-+12H++10Cl-,总的反应为:I-+3Cl2+3H2O=IO3-+6Cl-+6H+,当1:2<a:b<3:1时生成产物为碘单质和部分碘单质被氧化为IO3-,据此分析计算判断选项.
解答 解:A.氯气足量,碘单质被氯气氧化为IO3-,依据电子守恒、电荷守恒和原子守恒可知,发生反应为I2+5Cl2+6H2O=2IO3-+12H++10Cl-,故A正确;
B.当a=3b时,氯气恰好氧化碘离子为IO3-,发生反应的离子方程式为:I-+3Cl2+3H2O=IO3-+6Cl-+6H+,故B正确;
C.当a=2b时,介于1:2<a:b<3:1,此时生成产物为碘单质和部分碘单质被氧化为IO3-,发生反应的离子方程式为:5I-+10Cl2+9H2O=3IO3-+20Cl-+I2+18H+,故C正确;
D.若反应后溶液中I2与IO3-的物质的量之比为1:1,依据电子守恒可知,碘离子-1价变化为0价、+5价,电子转移总数为8e-,故D错误;
故选D.
点评 本题考查了氧化还原反应电子守恒、产物判断、离子方程式书写、定量关系的分析,主要是氧化还原反应电子守恒的理解应用,掌握基础是解题关键,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
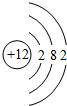 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑦ | C. | ②③④⑤⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g/mol | B. | 78g/mol | C. | 106g/mol | D. | 88g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| C | 加入盐酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| D | 取未知溶液进行焰色反应 | 火焰显黄色 | 溶液中一定含有K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com