
| ��ѧʽ | CH3COOH | H2CO3 | HClO | |
| ����ƽ�ⳣ�� | Ka=1.8��10-5 | Ka1=4.3��10-7 | Ka2=5.6��10-11 | Ka=3.0��10-8 |
| 1.12L |
| 22.4L/mol |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
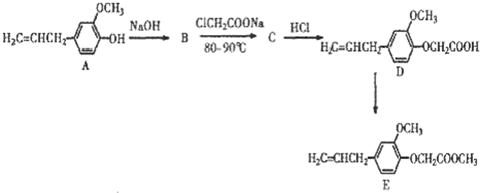
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NH4++H2O?NH3?H2O+H+ |
| B��Br-+H2O?HBr+OH- |
| C��CO32-+2H2O?H2CO3+2OH- |
| D��Fe3++3H2O?Fe��OH��3��+3H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
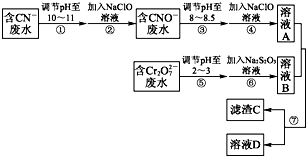
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��H+����c��F-�� |
| B��c��H+����c��HF�� |
| C��c��H+����c��OH-�� |
| D��c��HF����c��F-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���ڢٲ��г�ȥ�����е�SO42-��Ca2+��Mg2+��Fe3+�����ʣ������ҩƷ˳�����Ϊ��NaOH��ҺBaCl2��Һ��̼������Һ�����˺������ |
| B���ڢڲ��нᾧ����MgCl2?6H2O�����������м�������ˮMgCl2 |
| C���ڵڢܲ��еķ�Ӧ���ӷ���ʽΪBr2+SO2+2H2O=2H++SO42-+2HBr |
| D���ڢݲ��漰�ķ�������й��ˡ���ȡ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
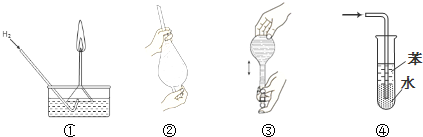
| A�������٣�ʹ���Խ���Һ���µĵ���©�����������Ĵ��� |
| B�������ڣ�ʹ��CCl4��ȡ��ˮ�е���ʱ���������ʹ©��������ų� |
| C�������ۣ���ʳָ��סƿ������һֻ����סƿ�ף���ƿ�������������ƿ�Ƿ�©ˮ |
| D�������ܣ����հ������Ȼ������岢��ֹ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com