
【题目】Pbl2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成Pbl2的实验流程如图
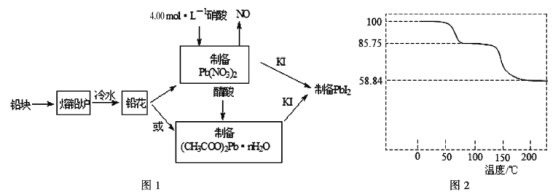
(1)将铅块制成铅花的目的是______________________________。
(2)①制备硝酸铅时,需要加热,但温度不宜过高,原因是______________________________。
②31.05g铅花用4.00 mol·L-1的硝酸溶解,化学方程式________________________________,至少需消耗4.00 mol·L-1硝酸__________mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中在__________(填仪器名称)中加热,测得样品固体残留率(![]() ×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水;(CH3COO)2Pb式量为325)。(CH3COO)2Pb·nH2O中结晶水数目n=__________(填数字)。
×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水;(CH3COO)2Pb式量为325)。(CH3COO)2Pb·nH2O中结晶水数目n=__________(填数字)。
(4)称取一定质量的PhI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbl2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500 mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00 mL。计算室温时PbI2的Ksp=__________。(保留4位有效数字)
【答案】增大与酸的接触面积,加快溶解反应速率 温度过高,硝酸会挥发分解 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O 100.0 坩埚 3 4.000×10-9
【解析】
根据影响反应速率的因素,铅块制成铅花为了增大表面积;硝酸易挥发;铅溶解于稀硝酸的反应方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,根据溶解的铅的物质的量可计算消耗的硝酸溶液的体积;固体加热用坩埚;可假设起始固体质量为100g,则加热到75℃时完全失去结晶水的质量就是固体减轻的质量,求算出水的物质的量及醋酸铅的物质的量,根据两者的物质的量之比可确定n值;根据酸碱中和的原理可计算出溶液中的H+的浓度,并结合关系式确定溶液里Pb2+的浓度,再计算Ksp,据此分析。
(1)将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率,答案为:增大与酸的接触面积,加快溶解反应速率;
(2)①硝酸受热易挥发、易分解,所以制备硝酸铅时,加热温度不宜过高答案为:温度过高,硝酸会挥发分解;
②铅和稀硝酸的反应方程式为:3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O;31.05g铅的物质的量为![]() ,根据反应方程式可知消耗的HNO3的物质的量为
,根据反应方程式可知消耗的HNO3的物质的量为![]() ,则硝酸溶液的体积为
,则硝酸溶液的体积为![]() ;答案为: 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O;100.0;
;答案为: 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O;100.0;
(3)加热固体用坩埚,假设样品的起始质量为100g,根据固体残留率的公式可知,75℃时剩余固体为85.75g,生成的水的质量为100g-85.75g=14.25g,则醋酸铅与水的物质的量之比为:![]() ,则n=3;答案为:坩埚;3;
,则n=3;答案为:坩埚;3;
(4)n(H+)=n(NaOH)=cV=0.002500mol∕L×20.00mL×10-3 =5.000×10-5mol;根据方程式2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq)可得n(Pb2+)=2.500×10-5mol,c(Pb2+)=![]() ;Ksp=c(Pb2+)c2 (I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9;答案为:4.000×10-9;
;Ksp=c(Pb2+)c2 (I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9;答案为:4.000×10-9;


科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是

A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)===CO2(g)+N2(g) △H= - 226 kJ·mol-1
C. 反应物的总键能大于生成物的总键能
D. 该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品,从而达到从废旧印刷电路板中提取铜的目的。某化学小组模拟该方法回收铜并制取胆矾,流程简图如下:回答下列问题:
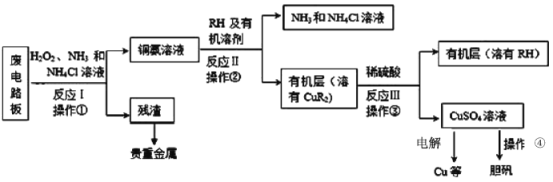
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,NH4Cl溶液主要作用是防止由于溶液中c(OH-)过高,生成__________(填化学式),影响铜的回收率。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,操作2的名称是__________,操作2的主要其目的是(填序号)__________。
a.富集铜元素
b.增加Cu2+在水中的溶解度
c.使铜元素与水溶液中的物质分离
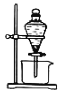
(3)反应Ⅲ的化学方程式为_______,若操作③使用下图装置,图中存在的错误有_______处。
(4)操作④由硫酸铜溶液制胆矾的主要步骤是__________过滤、洗涤、干燥。
(5)流程中可循环使用的试剂除了NH3和NH4Cl溶液以外,还有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )

A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂空气电池具有使用寿命长、可在自然空气环境下工作的优点。其原理如图所示(电解质为离子液体和二甲基亚砜),电池总反应为:![]() 下列说法不正确的是( )
下列说法不正确的是( )

A.充电时电子由Li电极经外电路流入Li2O2
B.放电时正极反应式为2Li++O2 +2e-=Li2O2
C.充电时Li电极与电源的负极相连
D.碳酸锂涂层既可阻止锂电极的氧化又能让锂离子进入电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。通过计算求:
(1)A的分子式是_____________(写出计算过程),其结构简式是____________________。
(2)写出A与乙酸反应的化学方程式:________________________________________。
(3)27.2gA在空气中充分燃烧时至少需要空气(标况下)多少L;生成的CO2用170ml 10mol/L的NaOH溶液吸收,反应后溶液中溶质的成分是____,其物质的量各是______;
(4)写出所有满足下列3个条件的A的同分异构体的结构简式。①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。写出这些同分异构体的结构简式_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
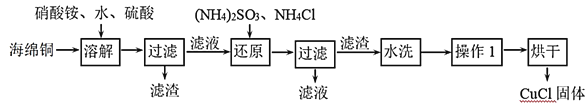
(1)还原过程中主要反应的离子方程式为_______。
(2)实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称__________,有关抽滤,下列说法正确的是__________
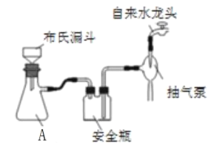
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
(3)操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂__________
A. 浓盐酸 B. 浓氨水 C. 无水乙醇 D. 水+乙醇
真空干燥的原因是___________。
(4)随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________
A. 增大 B. 不变 C. 减小 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
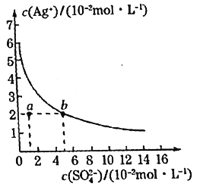
A.含有大量SO42-的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是3
C.可以通过改变温度或加入硫酸银固体使a点移动到b点
D.该温度下,0.02mol·L-1的AgNO3溶液与0.2mol·L-1的Na2SO4溶液等体积混合,不会生成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com