
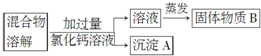
分析 除去氯化钠样品中的杂质碳酸钠,由实验流程可知,溶于水后,加过量氯化钙发生Na2CO3+CaCl2=CaCO3↓+2NaCl,则沉淀A为CaCO3,然后过滤分离出沉淀,对滤液蒸发得到NaCl,因氯化钙过量,则B中含NaCl、CaCl2;
若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳.
解答 解:除去氯化钠样品中的杂质碳酸钠,由实验流程可知,溶于水后,加过量氯化钙发生Na2CO3+CaCl2=CaCO3↓+2NaCl,则沉淀A为CaCO3,然后过滤分离出沉淀,对滤液蒸发得到NaCl,因氯化钙过量,则B中含NaCl、CaCl2;
(1)由上述分析可知,沉淀A为CaCO3,故答案为:CaCO3;
(2)因氯化钙过量,则B中含NaCl、CaCl2,故答案为:NaCl、CaCl2;
(3)若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,发生的化学反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:稀盐酸;CO32-+2H+═H2O+CO2↑.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应、混合物分离提纯方法解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 产生H2量:X>Y | B. | 反应消耗镁的量:X>Y | ||
| C. | 反应起始时速率:X=Y | D. | 反应一段时间后速率:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O$\frac{\underline{\;煮沸\;}}{\;}$Fe(OH)3↓+3HCl | |
| B. | 胶体分散质粒子的直径介于1~100nm之间 | |
| C. | 利用丁达尔效应可鉴别胶体和溶液 | |
| D. | 胶体和溶液都是混合物,它们属于不同的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═$\frac{\underline{\;通电\;}}{\;}$Na++H++SO42- | ||
| C. | Ca(OH)2═Ca2++OH- | D. | Na2CO3═2Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(1)△H=-114.6 kJ•mol-1此时中和热△H=-114.6 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ•mol-1 | |
| C. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com