
【题目】室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
加入的物质 | 结论 | |
A | 50mL1 mol·L-1硫酸 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molNa2O2 | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中可能存在共价键
B. 金属元素与非金属元素形成的化合物中一定存在离子键
C. 溶于水后形成的溶液能导电的化合物中存在离子键
D. 非金属元素形成的物质中一定存在共价键,可能存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列五种烃:①![]() ②
②![]() ③乙烷④正戊烷⑤
③乙烷④正戊烷⑤![]() ⑥
⑥![]() ,
,
其中互为同分异构体的是_________(填序号),② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(2)按系统命名法, 化合物(CH3)2CHCH(CH3)C(C2H5)2C(CH3)3的名称是___________,该烃可由_______种烯烃加成而得到.
(3)分子式为C5H9C1O2的同分异构体甚多,其中能与NaHCO3发生反应产生CO2的同分异构体共有________种;
(4)有机物M分子式为C4H8O3,同温同压下,等质量的M分别与足量的金属钠、NaHCO3溶液反应,可得到等量的气体;在浓硫酸存在下,M还能生成一种分子式为C4H6O2的五元环状化合物N。根据上述性质,确定C4H8O3的结构简式为________________,写出M→N对应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
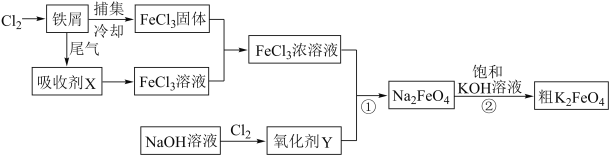
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com