
分析 (1)发生反应为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,反应后物质中只有二氧化锰不溶,则最终得到的8.7g为二氧化锰;
(2)利用差量法计算出分解的硫酸钾的质量,然后根据二氧化锰的质量计算出原混合物中硫酸钾的质量,从而可计算出硫酸钾的分解率.
解答 解:(1)发生反应为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,由于KClO3、KCl都易溶于水,只有二氧化锰不溶,且二氧化锰作催化剂,则最终得到的8.7g为二氧化锰的质量,
答:原混合物中二氧化锰的质量为8.7g;
(2)加热后质量变为28.4g,则反应过程中固体质量变化为:32.2g-28.4g=3.8g,
设反应分解的硫酸钾的质量为x,则
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑△m
245 96 48
x 3.8g
则:$\frac{245}{x}$=$\frac{48}{3.8g}$,
解得:x≈19.4g,
原混合物中硫酸钾的质量为:32.2g-8.7g=23.5g,
所以氯酸钾的分解百分率为:$\frac{19.4g}{23.5g}$×100%≈82.6%,
答:氯酸钾的分解百分率为82.6%.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握差量法在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题
 Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入合金的质量可能为5.6g | |
| B. | 参加反应的硝酸的物质的量为0.2mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为200mL | |
| D. | 标况下产物NO体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
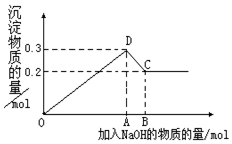 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2CO3 | C. | KAl(SO4)2•12H2O | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Z)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 若使用催化剂,则反应速率和X的转化率均增大 | |
| B. | 其他条件不变,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,则△H>0 | |
| C. | 其他条件不变,容器体积压缩到1.0 L,平衡常数将增大 | |
| D. | 温度不变,向容器中再充入2 mol X、1 mol Y,反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com