
市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④丝织品
A.① B.②③ C.①③ D.②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:填空题
(16分)下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)⑤、⑥、⑦的离子半径由大到小的顺序为 。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为 。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式: 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式 。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式: 。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为 。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
在下图点滴板上有四组溶液间反应的小实验,其对应的离子方程式书写不正确

A.a反应:Fe3+ + 3SCN-=Fe(SCN)3 B.b反应:HCO3-+ OH-=CO32-+ H2O
C.c反应:Al2O3+2OH-=2AlO2-+H2O D.d反应:Fe2++ 2H++ H2O2=Fe3++ 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:实验题
实验题:(共15分)
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
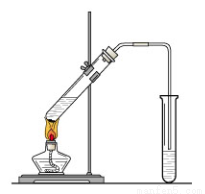
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(3)浓硫酸的作用是:① ; ② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
关于基本营养物质的说法正确的是
A.所有蛋白质均可通过颜色反应来鉴别
B.葡萄糖和蔗糖不是同分异构体,但属于同系物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
可以用分液漏斗进行分离的混合物是
A、酒精和碘水 B、苯和水 C、乙酸和乙酸乙酯 D、乙酸和水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s) 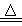 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
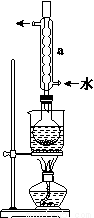
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是_________________ 。
Ⅱ测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O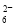 +2I-
+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
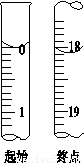
(5)如果滴定终点时俯视刻度线,所的结果 (填“偏大”“偏小”或“不变”)
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为______________________________________ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com