
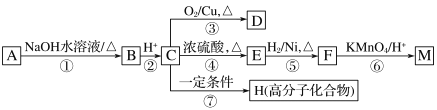
【题目】有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种。
已知:![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为__________、_________
(2)反应①~⑦中,属于消去反应的是_____________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________;反应⑦的化学方程式为__________
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中含有哪种卤素原子,确定该官能团的实验步骤和现象为_____________
(5)符合下列条件F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
【答案】![]()
![]() ④
④ 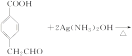
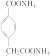 +2Ag↓+2NH3+H2O
+2Ag↓+2NH3+H2O ![]()
![]()
![]() +(n-1)H2O 取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子 2
+(n-1)H2O 取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子 2
【解析】
A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有﹣COOH,F的分子式为C9H10O2,其不饱和度为![]() =5,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种,说明F含有苯环,F中应含有乙基,且与羧基处于对位,故F为
=5,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种,说明F含有苯环,F中应含有乙基,且与羧基处于对位,故F为![]() ,M为
,M为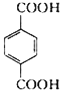 .由A→B→C的转化可知,C中含有﹣COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为
.由A→B→C的转化可知,C中含有﹣COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为![]() ,故D为
,故D为![]() ,B为
,B为![]() ,A的相对分子质量在180260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为
,A的相对分子质量在180260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为![]() ,X相对原子质量大于180﹣28﹣76﹣45=31,小于260﹣28﹣76=111,X可能为Cl或Br。C发生消去反应生成E为
,X相对原子质量大于180﹣28﹣76﹣45=31,小于260﹣28﹣76=111,X可能为Cl或Br。C发生消去反应生成E为![]() ,E与氢气发生加成反应生成F。C发生缩聚反应生成高聚物H为
,E与氢气发生加成反应生成F。C发生缩聚反应生成高聚物H为![]() 。
。
A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有﹣COOH,F的分子式为C9H10O2,其不饱和度为![]() =5,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种,说明F含有苯环,F中应含有乙基,且与羧基处于对位,故F为
=5,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种,说明F含有苯环,F中应含有乙基,且与羧基处于对位,故F为![]() ,M为
,M为 .由A→B→C的转化可知,C中含有﹣COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为
.由A→B→C的转化可知,C中含有﹣COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为![]() ,故D为
,故D为![]() ,B为
,B为![]() ,A的相对分子质量在180260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为
,A的相对分子质量在180260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为![]() ,X相对原子质量大于180﹣28﹣76﹣45=31,小于260﹣28﹣76=111,X可能为Cl或Br。C发生消去反应生成E为
,X相对原子质量大于180﹣28﹣76﹣45=31,小于260﹣28﹣76=111,X可能为Cl或Br。C发生消去反应生成E为![]() ,E与氢气发生加成反应生成F。C发生缩聚反应生成高聚物H为
,E与氢气发生加成反应生成F。C发生缩聚反应生成高聚物H为![]() 。
。
(1)B、F的结构简式分别为![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() ;
;
(2)反应①属于取代反应,还发生中和反应,反应②属于复分解反应,反应③⑥属于氧化反应,反应④属于消去反应,反应⑤属于加成反应,反应⑦属于缩聚反应,
故答案为:④;
(3)D发生银镜反应的化学方程式为: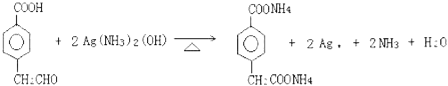 ;
;
反应⑦的化学方程式为:![]() ,
,
故答案为: ;
;![]() ;
;
(4)根据上面的分析可知,X可能为Cl或Br,要确定X是哪种官能团的实验步骤和现象为:取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子,
故答案为:取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子;
(5)符合下列条件的F(![]() )的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个﹣CHO,且2个甲基处于间位,另2个分别处于对位,结构简式为
)的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个﹣CHO,且2个甲基处于间位,另2个分别处于对位,结构简式为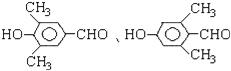 ,所以F的同分异构体有2种,
,所以F的同分异构体有2种,
故答案为:2。


科目:高中化学 来源: 题型:
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
I.甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 _____________________________。
II.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度______(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则______(填“甲”或“乙”)判断正确,试剂X是______(填字母序号)。
A.Ba(OH) 2溶液B.BaCl2溶液C.NaOH溶液D.澄清石灰水。
(2)将加热后的溶液冷却到10℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则______(填“甲”或“乙”)判断正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
![]() ―→
―→![]()
某化学兴趣小组将上述流程②③设计成如图所示:
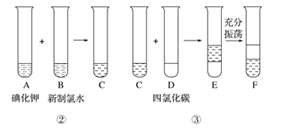
已知②中发生反应的化学方程式为Cl2+2KI=2KCl+I2
回答下列问题:
(1)写出提取过程①③中实验操作名称:①____,③____。
(2)四氯化碳是____色、密度比水____的液体。Y中下层液体的颜色为___色,上层液体中溶质的主要成分为_____。
(3)从碘的四氯化碳溶液中得到碘需进行的操作是______。
(4)在操作①过程中,使用到的实验仪器有____(多选)。
A.试管 B.烧杯 C.玻璃棒 D.蒸发皿 E.漏斗 F.铁架台 G.分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
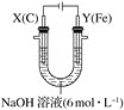
【题目】某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。
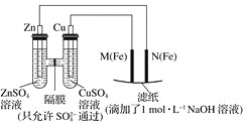
请回答:
Ⅰ.用如图所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为________。
(3)实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有__________________。
Ⅱ.用图所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH________(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-==Fe+4H2O和_____________。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示。
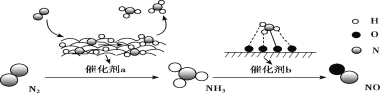
下列分析合理的是( )
A. N2与H2反应生成NH3的原子利用率为100%
B. 催化剂a、b能提高反应的平衡转化率
C. 催化剂a表面发生了极性共价键的断裂和形成
D. 在催化剂b表面形成氮氧键时,不涉及电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )
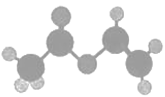
A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是

A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.碳酸钠溶液与石灰乳反应:CO32-+Ca2+=CaCO3↓
B.向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+2H2O+CO32
C.碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com