
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
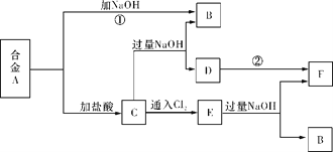
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
【答案】AlCl3、FeCl24Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀经灰绿色变为红褐色2Fe2++Cl2=2Fe3++2Cl-
【解析】
F为红褐色沉淀,应为Fe(OH)3,则说明合金A中含有Fe,则C中含有FeCl2,E含有 FeCl3;而合金A中另一种金属可与氢氧化钠反应,则应为Al;则A应为Al、Fe的合金,B为NaAlO2,由转化关系可以知道D为Fe(OH)2,据此解答。
合金A,能与氢氧化钠溶液反应,则合金A中含有铝,则B为偏铝酸钠,已知F为红褐色沉淀,则该沉淀为氢氧化铁,所以合金A中含有铁,则C为氯化铝和氯化亚铁,则D为氢氧化亚铁,C中通入氯气,氯化亚铁与氯气反应可生成氯化铁,则E为氯化铝和氯化铁,氯化铝和氯化铁溶液中加入过量的氢氧化钠可生成氢氧化铁和偏铝酸钠。
(1)由上述推断可知,溶液C的溶质主要是AlCl3、FeCl2;正确答案:AlCl3、FeCl2。
(2)反应②是氢氧化亚铁转化为氢氧化铁的过程,反应的化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3。氢氧化亚铁转化为氢氧化铁的现象为:白色沉淀经灰绿色变为红褐色;正确答案:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ; 白色沉淀经灰绿色变为红褐色。
(3) 反应C→E是氯化亚铁与氯气反应生成氯化铁的过程,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;正确答案:2Fe2++Cl2=2Fe3++2Cl-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某元素的原子为AZX,9.5g该元素的氯化物XCl2配成溶液后,需用200mL 1mol/L的AgNO3溶液才能把氯离子沉淀完全,已知,X元素核内质子数和中子数相等。
(1)据此请计算出A值______________,
(2)写出该元素符号并确定其在周期性表中的位置______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大。A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是__________________。
(2)下列事实能用元素周期律解释的是_____(填字母序号)。
a . D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b. E的气态氢化物的稳定性小于HF
c. WE3的溶液可用于刻蚀铜制的印刷电路板
(3)E的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是__________。
(4)①工业上用电解法制备D的单质,反应的化学方程式为____________________。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
① 上述反应的离子方程式为__________。
② D的单质与X在高温下反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铁、铜和稀硫酸组成的原电池,所发生的总反应的离子方程式是
A. Fe-2e-=Fe2+ B. Cu2++2e-=Cu
C. 2H++2e-=H2↑ D. Fe+2H+=Fe2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________(写化学式)
(2)基态Cr3+的核外电子排布式为_____________________。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________,C2O42-中碳原子的杂化轨道类型是___________,与H2O互为等电子体的离子是___________(任写一种)
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________(填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________pm。
③阿伏加德罗常数的值为NA,该晶体密度的计算表达式为___________g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释物质用途或现象的反应方程式不准确的是
A. 硫酸型酸雨的形成会涉及反应2H2SO3+O2![]() 2H2SO4
2H2SO4
B. 工业上制取粗硅的化学方程式:SiO2+C![]() Si+CO2↑
Si+CO2↑
C. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用含磷洗涤剂(含有Na5P3O10)会引起水域含磷量升高,造成环境污染,Na5P3O10中磷元素的化合价是( )
A. —3 B. +2 C. +3 D. +5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com