
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
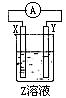
| A.1.00 mol/L | B.0.500 mol/L | C.2.00 mol/L | D.3.00 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们
80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们 的重视,水体中的无机汞主要有Hg2+、Hg22+。
的重视,水体中的无机汞主要有Hg2+、Hg22+。 +可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为: 。
+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为: 。 吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI
吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI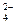 +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: 。
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.地壳中含量最多的元素是铝元素; | B.在自然界中铝以化合态存在; |
| C.NaCl的焰色反应呈紫色; | D.白色絮状沉淀Fe(OH)2可溶于NaOH溶液中。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 LiAlH4+ 3LiCl。
LiAlH4+ 3LiCl。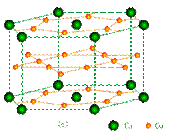

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁是人类最早使用的金属,铁的应用,经历了“铁—普通钢—不锈钢等特种钢”的演变过程 |
| B.黑色金属材料及其它们的合金是应用最广泛的金属材料 |
| C.金属镁有“国防金属”的美誉,也被誉为“21世纪的金属” |
| D.铜绿的主要成分是碱式碳酸铜,这是铜在潮湿空气中发生电化学腐蚀的结果 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na、Mg 、Al | B.Na、K 、Zn |
| C.Fe、Cu、Ag | D.Na、Ca、K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com